Състояние на силните електролити във воден разтвор
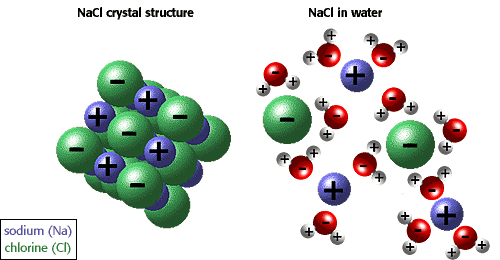
В класичната форма на теорията на електролитната дисоциация залегнаха предпоставките: йоните в разтвора не си взаимодействат и подвижността на йоните не зависи от концентрацията. Докато за слабите електролити това е донякъде приемливо, за силните електролити положението е по-друго. И Дебай и Хюкел...