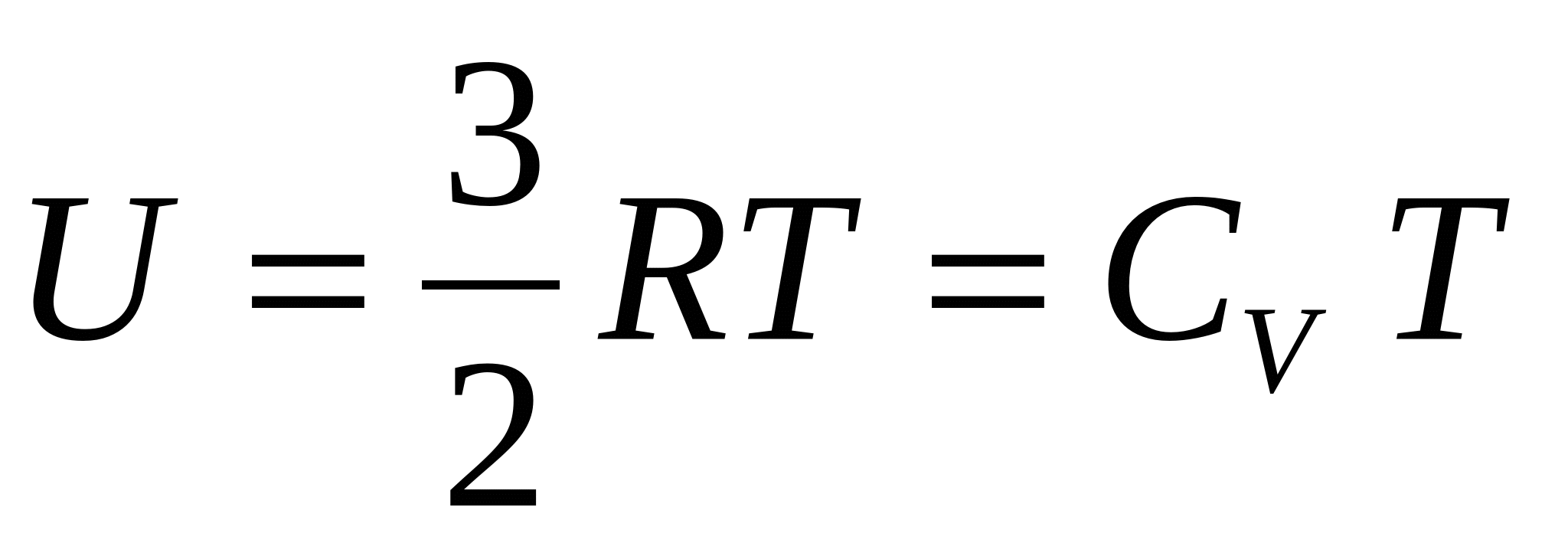
Термодинамиката е дял от физиката. В основата си тя изучава превръщането на топлината в работа и обратно (при макросистемите). Онази част от нея, която има за предмет химичната енергия и нейните превръщания, представлява химичната термодинамика. Термодинамиката има за основа термодинамичните принципи, изведени върху основата на широко и обхватно обобщение, и вековния опит. Всички енергитични процеси в макросистемата стоят в съответствие с тези най-общи закони и като такива са придобили названието принципи или начала.
Оперира се със следните по-основни понятия в термодинамиката:
- Термодинамичната система е микроскопска съвкупност от тела, между които се извършват процеси, свързвани с енергитични промени. Тя бива хомогенна - когато малки избрани на различни места, но еднакви по големина обеми, статистически са еднакви по състав, строеж и брой на градивните частички. Например газа, смес от газове, течността и прочие; хетерогенна - когато системата не отговаря на определениета хомогенна система. Характерното при хетерогенните системи е граничната повърхност между хомогенните съставни части, наричана в случая фазова граница. Отделните хомогенни съставни части на хетерогенната система се наричат фази. Системата лед-вода, при която съществуват две фази, разделени с една фазова граница или гранита, при който са налице три твърди фази (фелдшпат, кварц, слюда) със съответни фазови граници и прочие. Химична система - съвкупност от тела, между които в по-малка или по-голяма степен протичат процеси със съответен енергитичен ефект и промяна на химичната природа на компонентите - Zn и H2SO4, CaO и H2O и прочие.
- Физическата система е съвкупност от тела, между които протичат процеси с енергитичен ефект без изменение на химичната природа на компонентите - изменението на агрегатните сътояния на веществата и прочие.
- Откритата система - случай, при който се извършва енергитичен обмен и веществен обмен с други системи или окръжаващата среда.
- Затворената система - осъществява с други системи само енергитичен обмен, но не и веществен.
- Изолираната система, при която липсва енергитичен и веществен обмен с други системи - такива са процесите, протичащи в реактори с много добра термична изолация (Дюаров съд) или взривни процеси, при които енергитичните промени в системата протичат с несравнимо много по-голяма скорост, отколкото отдаването навън или приемането отвън на енергия.
Съвкупността от всички свойства на една система представлява нейното състояние. Параметрите са Т - температурата, p-налягането, V-обема и c - концентрацията. Променя ли се един от параметрите на системата, протича процес. В противен случай се намира в равновесие.
Енергията, която се намира в една система в "скрита" форма, характеризира енергитичния й запас. Означава се като вътрешна енергия със знака U. Тя е сума от постъпателното, ротационното, осцилационното движение на атомите и молекулите, движението на електроните, енергията на химичната връзка, вътрешноядрената енергия и прочие. Абсолютната й стойност не може да се определи, а се определя разликата (ΔU) между две вътрешни енергии на две различни състояния при даден процес. Ако енергията се увеличава, отчита се като положителна величина, ако намалява - като отрицателна -ΔU = U1-U2; +ΔU при U1>U2; -ΔU при U1<U2. Вътрешната енергия на системата е функция от състоянието й. Тя се дава с уравнението на състояние U=f(pVTc).
В зависимост кой параметър е постоянен и неизменен термодинамичните процеси биват изотермични - при постоянна Т, изобарни - при постоянно p, изохорни - при постоянен V и адиабатни - при Q=0, тоест системата не обменя топлина с окръжаващата околност
Първият термодинамичен принцип е частен случай от закона за запазването на енергията. Той гласи: в една затворена сситема различните видове енергии преминават една в друга в строго определени еквивалентни количества, като вътрешната енергия на системата остава постоянна. Математичният израз е ΔU=U1-U2=0.
Ако в системата се внесе известно количество топлина Q, тя се изразходва както за увеличаване на вътрешната енергия на системата ΔU така и за извършване на работа или Q=ΔU+A (1).
Ако системата е газообразна и процесът е изобарен, работата А ще се върши за увеличение на обемам при A=pΔV. Така че от уравнението (1) се получава Qp=ΔU+pΔV (2). Изразът U+pΔV, тоест сумата от вътрешната енергия на системата и произведението от външното налягане p по обема на системата ΔV се нарича енталпия. Фактически тя изразява топлинното съдържание на системата и се бележи с H. И тук подобно на вътрешната енергия енталпията не може да се измери, а се определя нейното изменение ΔH. При процеси с отделяне на топлина енталпията е отрицателна (-ΔH), а при процеси с поглъщане на топлина - положителна (+ΔH). Енталпията е също функция на състоянието.
Първият термодинамичен принцип регламентира невъзможността да се получи "перпетуум мобиле" първи род, тоест двигател, който да работи вечно от нищо или само от първоначален тласък.
Вторичният термодинамичен принцип се отнася за посоката на самоволно протичащите химични или физични процеси, както и възможността или невъзможността за тяхното реализиране. Известно е, че топлината преминава самоволно от по-горещото тяло към по-студеното, предметите падат самоволно невъзможни, освен ако не се изразходва известно количество енергия.
Вторият термодинамичен принцип, даден от Клаузиус (1851) гласи: топлината не може да преминава самоволно от по-студено към по-топло тяло. Съществуват и други формулировки. Самоволен е процесът, когато протича без външни въздействия и оставя в окръжаващата среда или в системата трайни изменения. И във връзка с това термодинамиката разглежда процесите като необратими и обратими.
Термодинамично е необратим онзи процес, който протича самоволно в една посока, но не може да се върне в обратна посока, без да се извърши механична работа или изразходва известно количество топлина. Необратими са всички природни процеси и топлинните процеси в техниката, при химичните взаимодействия, включително и жизнените процеси. Термодинамично обратим би трявало да бъде онзи процес, който при самоволното му протичане в една посока може да върне процеса в обратна посока, без да има някакво изменение в околната среда. Очевидно такъв природен процес не съществува. Във връзка с тов се регламентира "перпетуум мобиле" втори род - не може да се построи машина, която да работи за сметка на топлина, отнемана от един топлинен резервоар. Съгласно вторият термодинамичен принцип е възможно превръщането на работата в топлина, но пълното превръщане на топлината в работа е невъзможно - една част от топлината се губи. За различните системи (машини, химични процеси и жив организъм) превръщането на топлината в работа се изразява с така наречения термодинамичен коефициент на полезно (к.п.д.), даван в проценти.
Количеството работа зависи от температурната разлика между топлинния източник (Т1), и топлинния консуматор (Т2) или A=(Q/(T1-T2))/T1. Това е математичният израз на втория термодинамичен принцип. Ако предположим, че Т2 е равно на нула, работата А става на Q, тоест само при абсолютната нула е възможно превръщането изцяло на топлината в работа и к.п.д. е равно на 100%. За реалните процеси, протичащи винаги над абсолютната нула, к.п.д. е винаги по-малко от 100%. За реалните процеси, протичащи винаги над абсолютната нула, к.п.д. е винаги по-малко от 100%.
Отношението между обмененото количество топлина ΔQ и абсолютната температура T се обозначава като ентропия със символа S. Абсолютното количество ентропия не може да се измери. Подобно на вътрешната енергия се работи с разликата между ентропиите на две състояния на системата S2-S1=ΔS. Така че ентропията ΔS=(ΔQ)/T е мярка за необратимостта на един процес, тоест вероятната посока на протичане на процеса. По-голямата й стойност на дадено състояние спрямо първото, изходното показва, че процесът протича от първото към второто. За реалните процеси ентропията нараства, тоест:
S2-S1=ΔS>(ΔQ)/T.
За обратимите, мислимо допуснати, енетропията е постоянна ΔS+O.
Двата термодинамични принципа (съответно уравненията им) могат да бъдат обединени в един израз ΔU=ΔQ-ΔA(3) и ΔS=(ΔQ)/T или ΔQ=TΔS(4). Ако се замести в уравнението (3) ΔQ с ΔQ от уравнението (4). Ако се замести в уравнението (3) ΔQ с ΔQ от уравнение показва, че вътрешната енергия на една система се състои от ентропията TΔS, която не може да преминава в работа, наричана в случая свързана енергия и ΔA, която преминава в работа, наричана в случая свързана енергия и ΔA, която преминава в работа и се нарича свободна енергия. Ако съществува химичен процес, който протича при постоянна Т и постоянен обем V (изотермо-изохорен) свободната енергия ΔА се бележи с ΔF и се нарича термодинамичен потенциал на Хелмхолц. Ако е пък при постоянна температура Т и постоянно налягане p (изотермо-изобарен), свободната енергия ΔА се отбелязва с ΔG и се нарича термодинамичен потенциал на Гибс.
Свободната енергия се явява параметър за възможното протичане на химичните процеси. Термодинамично, самоволно протичащи процеси са онези, при които свободната енергия намалява. При термодинамичното равновесие тя показва минимум, с други думи казано, системата не може да извършва работа или ΔG или ΔF са равни на нула.
Когато системата извършва работа, тя се приема за положителна (+ΔA), като свободната енергия намалява (-ΔG съответно -ΔF). Във връзка с казаното, ако преобразуваме уравнението (5), като заместим ΔU и ΔH (енталпията) и ΔA съответно с ΔG съответно с ΔF получаваме ΔH=TΔS+ΔG съответно ΔH=TΔS-ΔF, откъдето следва ΔG=ΔH-TΔS съответно ΔF=ΔH-TΔF. Това уравнение се означава като уравнение на Гибс-Хелмхолц. То изразява връзката между свободната енергия (G, F), ентропията S и енталпията H на една система.
Познаването на стойността на ΔG на изотермо-изобарните химични процеси позволява да се направи преценка на възможността или невъзможността за протичането на процесите. Възможни са следните процеси:
- ΔG има отрицателна стойност (-ΔG). Процесът термодинамично е възможен, тъй като свободната енергия намалява. Тези процеси се обозначават като екзергонни. Например C+O2=CO2; ΔG=-93,8 kcal/mol.
- ΔG има положителна стойност (+ΔG). Процесът термодинамично е невъзможен. Например реакцията N2+1/2*Q2=N2O; ΔG=+24,8 kcal/mol. Но N2O е отдавна познато съединение, което се получава по друг начин, но не и по пътя на синтезата, която термодинамиката отрича. Процеси с положителна стойност ΔG се наричат ендергонни.
Промяната на свободната енергия (ΔG) при реакция, протичаща при стандартните условия 250C и 1 атмосфера за грам-мол, се отбелязва със знака ΔG0 и се нарича стандартна свободна енергия.