Ако се вземе съединението H2O2 (водороден прекис / водороден пероксид) - 30%-ов воден разтвор и се наблюдава, видима промяна не се забелязва. Но прибави ли се в него сребърен прах, MnO2 и други неразтворими в средата вещества, които не реагират с H2O2, вижда се внезапно буйно разлагане на това съединение с отделяне на газ и топлина. Водородният прекис е ендотермично съединение, нестабилно за обикновена температура и като такова бавно се разлага по химичното уравнение 2H2O2 = 2H2O+O2. Прибавят ли се току-що споменатите вещества, разложителният процес буйно протича с отделяне на кислород и определено количество топлина.
Тези прибавки се означават като катализатори. Следователно катализаторите променят скоростта на химичната реакция, без да се изразходват или променят състава си. Самото явление се назовава катализа. По характерните черти и особености на катализата са следните:
- Катализират се изключително само онези химични процеси, които кротичат и без катализатор, независимо от тяхната скорост.
- Едни катализатори увеличават извънредно много скоростта на реакцията. Наричат се положителни катализатори (положителна катализа).
- Други катализатори намаляват извънредно много скоростта на реакцията. Наричат се отрицателни катализатори (отрицателна катализа). Към този тип катализатори принадлежат антиокислителните катализатори, които силно забавят окислителния процес. Често пъти веществата, забавящи химичните процеси, се наричат инхибитори, без да се държи сметка, че в някои случаи те променят състава си.
- Катализаторите не предизвикват химична реакция, тоест те не могат да изместват равновесното състояние на химичната система. Системата H2 / O2 се катализира до съответното равновесно състояние H2O, но не съществува катализатор, който да разлага водата на водород и кислород.
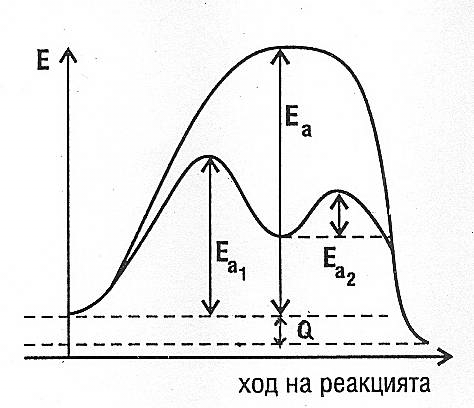
- Съществуват случаи, при които един от крайните продукти на правата реакция се явява неин катализатор. Говори се за автокатализатор и автокатализа. Например при реакцията 3Ag+4HNO3=3AgNO3+NO+2H2O азотните окиси се явяват автокатализатор на разтварянето на среброто в азотна киселина и прочие. Очевидно при автокатализата скоростта на реакцията преминава с времето през максимум.
Катализата бива хомогенна и хетерогенна. Първата е налице, когато реагиращата система и катализаторът са в едно агрегатно състояние (в изключение на твърдо-твърдо), а втората - когато са в различни агрегатни състояния (включително и случая твърдо-твърдо). Понякога втората се нарича контактна. Когато катализаторът (твърд) е в колоидни размери, говори се за микрохетерогенна катализа.
Хомогенна катализа.
Пример за тази катализа е получаването на H2SO4 по камерния метод, хидролизата на скорбялата от водородните йони и прочие. Тук скоростта на каталитичната реакция е пропорционална на концентрацията на катализатора.
Обяснението на този тип катализа е върху основата на получаване на междинни съединения между катализатора и един от реагиращите продукти, които реагират с втория реагиращ продукт, при което катализаторът се възстановява. В общия случай схемата е A+B=AB. Катализаторът е К. Ролята му е както следва: А+К=АК; АК+Б=К+АБ.
При процеса SO2+1/2O2=SO2, при което NO е катализаторът в съответствие със схемата, процесите са както следва: 1/2О2(А)+NO(K)=NO2(AK); SO2(B)+NO2(AK)=SO3(AB)+NO(K).
Отрицателната катализа при хомогенната катализа се свежда или до унищожаване на съществуващ положителен катализатор, или до дезактивиране на активните градивни частички, които участват в химичния процес от страна на отрицателния катализатор.
Хетерогенна катализа
Примери: контактният метод за получаване на H2SO4 (SO2-O2, катализатор Pt); разлагането на H2O2 и KClO3 (катализатор MnO2), съединяването на H2 и O2 (катализатор Pt) и прочие.
При тази катализа скоростта на реакцията не е пропорционална на количеството катализатор. Поради това, че процесите са гранично повърхности, скоростта зависи само от развитата допирна повърхност. Катализаторът се внася в реагиращата система винаги в силно раздробено състояние.
Известни са катализатори, които действат специфично, избирателно върху даден химичен процес при две възможни реакции. Например C2H3OH=H2O+C2H4-1- (етилен) и C2H5OH=H2+CH3CHO-2- (ацеталдехид). Ако се внесе като катализатор Ni или Al2O3, облагоприятства се реакция 1 - образува се C2H4, и обратно, ако се внесе Cu облагоприятства се реакция 2 - образува се CH3CHO.
Познати са случаи, при които определени вещества, внесени в даден катализатор, силно увеличават каталитичната му способност, без да са катализатори. Това са така наречените промотори или активатори. Например внесен цериев окис в никела увеличава каталитичната му способност около 17 пъти. Промотори на железния катализатор са Cr, Ti, Al2O3 и други.
Ако се смесят два катализатора, получават се смесени катализатори. Двата катализатора CuO и MnO2 изграждат катализатора хопкалит, важен за реакцията CO+1/2O2=CO2 и прочие. Каталитичната способност на смесения катализатор не е средна аритметична от каталитичните способности на двата катализатора. Тя е неколкократно по-голяма от нея.
И тук са известни отрови на катализаторите - CO е отрова на Cu-ния катализатор, As-овите съединения на Pt-овия катализатор и прочие. Най-общо отравянето се свежда до блокиране на повърхността на твърдия ктализатор. Съществуват факти на специфично, избирателно отравяне на катализатора. CO се явява отрова на Pt-овия катализатор при разлагането на N2O, но не и за процеса между CO и H2 и прочие.
Установено е, че отровата проявява своето действие при количества далеч по-малки от онези, при които става плътно покриване на повърхността на катализатора, което говори, че от значение за каталитичната активност не е цялата негова повърхност, а отделни участъци центрове, които се нарекога активни места или активни центрове. Тези места се оказаха от значение и за адсорбционната пособност, реакционната способност на твърдите вещества и прочие. За тяхната природа има няколко мнения. Но установен факт е, че колкото по-голяма е концентрацията на активните места, толкова съответно е по-изразена каталитичната активност, адсорбционната способност и прочие на твърдите системи.
Обяснението на хетерогенната катализа се основава на така наречената активирана адсорбция на реагиращите вещества. Последните, като се адсорбират върху повърхността на катализатора, в частност върху активните места, се активизират, което се изразява в разпадането на молекулите на атоми и прочие под влиянието на силовото повърхностно поле на твърдия катализатор. Активизирани по този начин градивните частички на реагиращите вещества взаимодействат помежду си с по-голяма скорост. Установено е активизиране и върху основата на химични процеси между реагиращите вещества и повърхността на катализатора. Получават се междинни, нетрайни съединения, които като се разлагат, дават съответните крайни продукти и катализаторът отново се възстановява.
Върху основата на факта, че влагата или много малките количества вода, включени в реагиращите вещества, дават отпечатък върху скоростта на химичните процеси, в миналото се смяташе, че водата се явява нещо като "универсален" катализатор. Понастоящем това е отречено.
Катализата е важна както в теоритично, така и в практическо отношение. Смело може да се каже, че най-важните успехи на химичната промишленост са тясно свързани с промишлената катализа. Засега се наброяват около 300, а може би и повече каталитични процеса, които са развити в промишлен мащаб. Получаването на сярната и азотната киселина, амоняка, синтетичния бензин, синтетичния каучук, хидрирането на мазнините и прочие са немислими без катализатори. Микрохетерогенната катализа е от особено значение при биохимичните процеси, които протичат под влиянието на ферментите (ензимите). Последните се характеризират с високата си каталитична активност и с голямата си химична избирателност в смисъл, че ускоряват едни процеси, а други забавят и освен това са способни да се инактивират. Предполага се, че в човешкия организъм функционират около хиляда вида различни ферменти, които са от решаващо значение за жизнените функции.