Закон за съхранението и съществуването на химичните елементи, изказан от Бойл. Обяснявал се с вечността и неизменяемостта на атомите - основно положение в атомното учение на Демокрит. Понастоящем е известно, че при подходящи условия един елемент може да се превърне в друг.
Закон за съхранението на масата (запазване на веществото по маса), експериментално установен от Ломоносов и преоткрит и наложен 31 години по-късно от Лавоазие. Понастоящем се дефинира масата на веществата, които реагират помежду си в една затворена система, е винаги равна на масата на веществта, които се получават при това реагиране или при всички химични процеси в една затворна система масата на реагиращите вещества остава непроменена.
Лавоазие е работил с точност на масите на 0,001 г. Впоследствие законът е проверяван с везни до все по-малки и по-малки маси от Ландолт, Етвьош, Рамзей, Грей до 0,000001 мг. Законът се оказал верен и до такива малки маси.
Всъщност законът има своя пределност от гледна точка на споменатото е уравнението на Айнщайн. Тъй като в него фигурира скоростта на светлината c2=9*1020cm/s изменението на масите при обикновените химични процеси поради енергитичните промени е извънредно малко. На енергитичен ефект 1 kcal отговаря промяната в масата около 5*1010cm/s.
Закон за постоянния състав на химичните съединения. Той гласи: от каквито и вещества и по какъвто и начин да се получава дадено съединение неговият състав остава постоянен. Установяването на този закон е плод на осемгодишен спор между Бертоле и Пруст (1801-1807). Първият е твърдял, че в зависимост от условията химичното съединение ще има променлив състав, а вторият, че ще има постоянен състав. Спорът се решил в полза на Пруст.
Понастоящем е установено, че наред със съединенията с постоянен състав, съществуват съединения и с променлив състав - междуметалните съединения. Първите по предложение на известния руски учен Курнаков са нарекли далтоници, а вторите - бертолиди.
Закон за кратните отношения, установен от Далтон (1803) гласи: ако два химични елемента образуват няколко съединения, различните масови количества от единия елемент, които се свързват с едно и също количество от другия елемент, се намират в отношение на прости цели числа. Например при процеса N2 + 3H2 = 2NH3 отношението на обемите е 1:3:2, при процеса 2H2 + O2 = 2H2O е 2:1:2 и прочие.
Всъщност Гей Люсак не е установил напълно прости цели числа. Това го е отдавал на грешки в опита. В действителност както при всички газови закони, които са валидни за идеалните газове и невалидни напълно за реалните газове, така и този газов "химичен" закон е валиден за идеалните газове и неприложим изцяло, точно за реалните, реагиращи помежду си газове.
Закон за еквивалентните, изказан от Воластон (1814), гласи: химичните елементи взаимодействат помежду си не в случайни а в строго определени количествени отношения. Количественият анализ показва, че 1g водород реагира с 8g кислород; 1 g водород се свързва с 35,5 g хлор; 1 g водород взаимодейства със 79,9g бром и прочие, както 20g калций реагират с 8g кислород, с 35,5g хлор и така нататък. Това са еквивалентните. Като се приеме еквивалентната маса на водорода, равна на единица, еквивалентът на химичните елементи се дефинира като масово количество, което взаимодейства с масова част (по-точно 1,008g) водород или я измества от неговите съединения. Понятието еквивалент се прилага и към химичните съединения - основи, киселини и прочие.
Закон на Авогадро (1811) гласи: равни обеми от различни газове при еднакви условия - температура и налягане, съдържат еднакъв брой частички (молекули). Ако обемите са по 1cm3 , броят на молекулите при нормални условия (213,12K) е равен на 2,69*1019 (Лошмидтово число). Законът се формулира още и така; еднакъв брой молекули от различни газове при еднакви условия имат един и същ обем. Ако се вземат грам-молни количества от различни газове (количества равни на молекулните им маси), в които броят на молекулите е 6,02*1023 (Авогадрово число), при нормални условия обемът им е един и същ, равен на 22,414 литра. Този закон изигра голяма роля - историческа, в установяването на понятията атом, молекула, точното определяне на атомните и молекулните маси. Той дава възможност за превръщане на масови количества от газове в обеми и обратно, като се знае, че всички газове, взети в молекулни количества при нормални условия имат грам-молния обем 22,414 литра.
Изграждане на основите на атомно-молекулната теория
След като Далтон приписал нови ценни страни на атомите, първите задачи, които непринудено възникнали, били обозначенията на различните видове атоми - изграждането на химичната символика, "съединителните маси" и особено атомните отношения, в които се свързват елементите помежду си и числените стойности на атомните маси на различните елементи.
Първични основи на химичната символика датират отпреди създаването на химичната атомистика. Тя е засягала някои химични елементи и съединения. Обозначаването им е било много странно, граничащо едва ли не с йероглифи. Далтон въвел по-проста символика, в основата на която били кръгчета с допълнителни знаци в полето на кръгчето. Водородът бил обозначаван с кръгче с точка, кислородът с кръгче, азотът с кръгче с вертикална черта, сярата с кръгче с плюсче, водата с две съединени кръгчета, лявото без точка, а дясното с точка, и сероводородът с две кръгчета, лявото от които с точка, а дясното с плюсче. Чрез кръгчетата Далтон като че ли приел че формата на атомите е сферична. Тази Далтонова символика била заменена с предложената през 1819 година от Берцелиус символика, върху основата на която стояли латинските (много рядко гръцките) названия на елементите - първата буква от названието и една от следващите букви при случаите, когато два или повече елемента започват с една и съща буква. Но и при тази символика, въпреки че е запазена и понастояем, се наблюдават известни непълноти. Химичните формули на съединенията се изграждат от съответните химични знаци на елементите. Както химичните знаци, така и химичните формули имат освен качествено още и количествено значение за съответното вещество.
Втората задача се оказала относително сложна. Относно "съединителните маси", в които се свързват елементите помежду си, те са отразени в закона за еквивалентите. Било е известно за времето на Далтон, че 1g водород се свързва с 8g кислород, като се получава вода. 1g водорост - с 16g сяра, като се получава сероводород, 1g водород с 35,5g хлор, като се получава хлороводород и прочие. Но не били известни атомните отношения, в които се свързват елементите помежду си. На този въпрос Далтон отговорил, като допуснал (погрешно), че атомите се съединяват почти винаги в най-прости отношения - един атом от единия елемент с един атом от другия елемент. Това приемане на Далтон, опитно недоказано, но прието от редица изследователи, определило в продължение на десетки години лутаница относно точната стойност на атомните маси и точното написване на химичните формули. като приел атомната маса на водорода равна на единица, при масово отношение водород към кислород 1:8, следвало при атомно отношение на водород към кислород 1:1 атомната маса на кислорода да е равна на 8, при същите разсъждения за сярата атомната маса да е 16 и прочие. При атомно отношение 1:1 очевидно стойностите на атомните маси съвпадали с тези на еквивалентните им маси, и химичните формули съответно да бъдат при Берцелиусовата химична символика за водата HO, за сероводорода HS, за амоняка HN и прочие. Но възникнал въпросът Далтоновото приемане действително ли е така или не. Някои изследователи не се съгласили с Далтон и приели, че атомното отношение освен 1:1 може да бъде 2:1, 2:3 и прочие и очевидно при едно и също отношение на съединителните (еквивалентните) маси в зависимост от различните атомни отношения се получавали за определен химичен елемент различни стойности за атомната маса. За кислорода при масово отношение 1:8 и атомно отношение 1:1 атомната маса е 8, а при 2:1 атомната маса е 16, при 1:2 тя е 4 и прочие. Далтон издал таблица със стойностите на атомните маси на известните за неговото време химични елементи при приетото от него атомно отношение 1:1. Сравнени с днешните атомни маси на тези елементи се вижда, че в едни случаи те са два пъти, друг път - три пъти по-малки, в някои случаи пък съвпадат (за хлора) и прочие. Онези изследователи, които не са били съгласи с Далтоновото атомно отношение, и те издавали атомни таблици. В края на краищата за един и същ химичен елемент много често са фигурирали няколко стойности на атомната маса (за кислорода или 8, или 16).
Правилното разрешение на въпроса за определяне на точната стойност на атомните маси и оттук точното написване на химичните формули допринесъл простият "химичен" газов закон на Гей-Люсак. За елементите газове Далтон и неговите последователи Берцелиус и други, твърдо отстоявали, че градивните частички са атомите, които са неделими. Законът на Гей-Люсак, както по-горе бе изтъкнато, регламентира, че газовете-химични елементи се свързват в прости обемни отношения например водородът и кислородът 2:1, при което се получават 2 обема водни пари, водородът и азотът 3:1, при което се получават 2 обема амоняк и прочие. Ако искаме да съчетаем закона на Гей-Люсак за простите обемни отношения с Далтоновата представа, че градивните частички на газовете са атомите, принудени сме да приемем делимост на атомите.
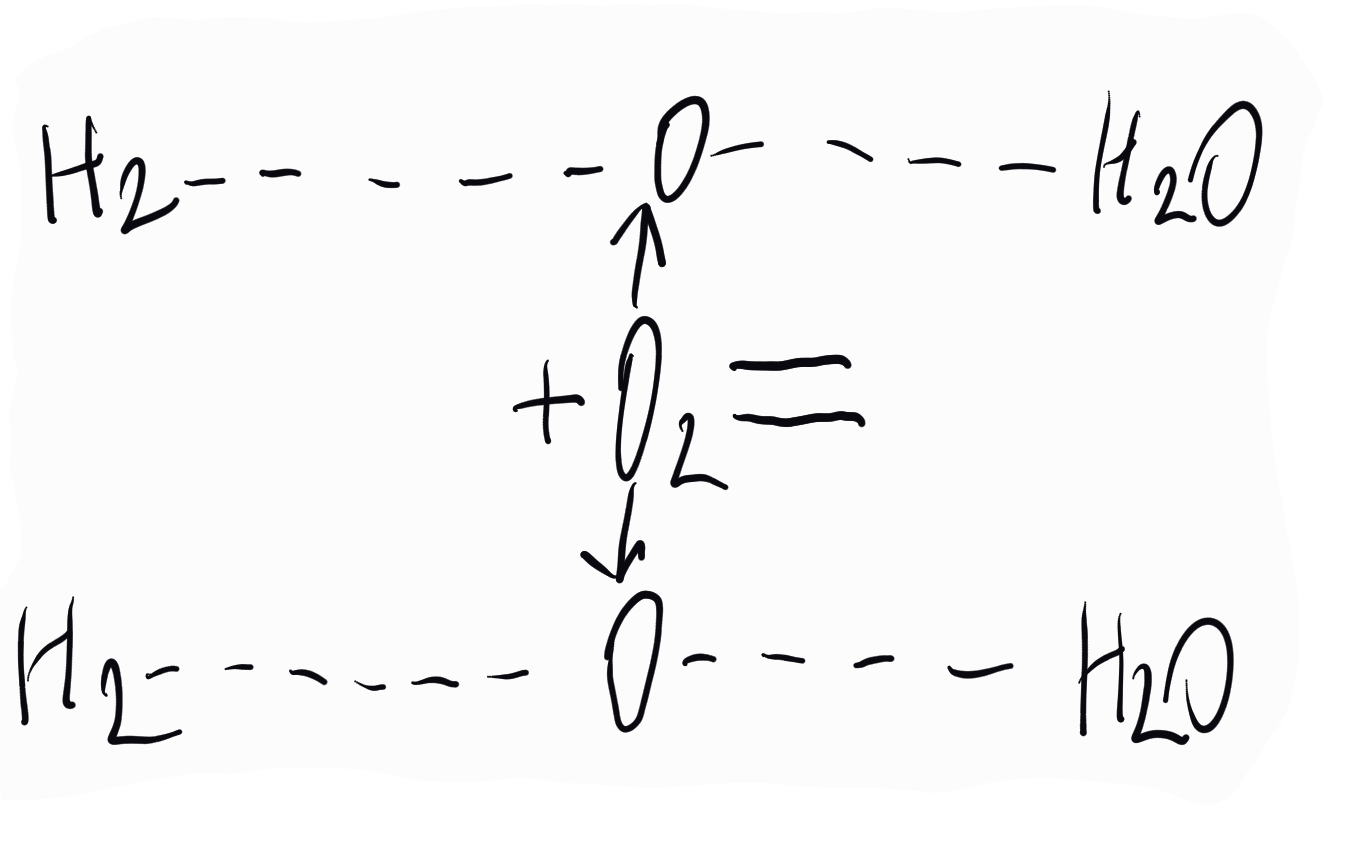 Да вземем за пример системата водород-кислород-водни пари. Илюстративно имаме според закона на Гей-Люсак два равни обема водород, като реагират с един раен на тях обем кислород, даватдва равни обема водни пари, тоест че частичките от двата обема водород реагират с частичките от единия обем кислород, при което, ако искаме да изразим закона на Гей-Люсак, принудени сме безусловно да разделим кислородните частички по на две. Но при предпоставката, че частичките са атоми, това не можем да приемем, тъй като атомите са неделими. Прие се, че градивните частички в обемите на газовете водород и кислород не са атоми, а по-големи частички, които са неделими. Впоследствие чрез трудовете на редица други учени - Лоран, Жерар, Авогадро, Каницаро и други се подчерта, че тези по-големи частички са двуатомни молекули. Градивните частички на газовете-химични елементи не са атомите, а молекулите.
Да вземем за пример системата водород-кислород-водни пари. Илюстративно имаме според закона на Гей-Люсак два равни обема водород, като реагират с един раен на тях обем кислород, даватдва равни обема водни пари, тоест че частичките от двата обема водород реагират с частичките от единия обем кислород, при което, ако искаме да изразим закона на Гей-Люсак, принудени сме безусловно да разделим кислородните частички по на две. Но при предпоставката, че частичките са атоми, това не можем да приемем, тъй като атомите са неделими. Прие се, че градивните частички в обемите на газовете водород и кислород не са атоми, а по-големи частички, които са неделими. Впоследствие чрез трудовете на редица други учени - Лоран, Жерар, Авогадро, Каницаро и други се подчерта, че тези по-големи частички са двуатомни молекули. Градивните частички на газовете-химични елементи не са атомите, а молекулите.
При това положение на нещата можа да се обясни законът на Гей-Люсак и дадат точни химични формули. За водата химичната формула не е HO в духа на Далтон, Берцелиус и други, а H2O, при което атомната маса на кислорода е 16.
Тези въпроси от днешна гледна точка извънредно елементарни намериха своето оконателно решение на Първия международен конгрес на химиците през 1860 г. в Карсруе (Германия). На него благодарение на авторитета на известния италиански професор Каницаро и неговото убедително слово се дадоха правилни насоки в определянето на атомните маси на химичните елементи, молекулните маси на химичните съединения, точните химични формули на съединенията, окончателното приемане на закона на Авогадро, който изигра голяма решаваща роля по въпроса за градивните частички на простите газови системи и прочие.
На този исторически конгрес химичната атомистика прерасна в стройна атомно-молекулна теория.
Атомна маса и молекулна маса
Атомните маси, които бяха дадени от Далтон впоследствие, както и тези, прието за единни на конгреса в Карлсруе, не представляват абсолщтните маси на отделните атоми. Те имат извънредно малки стойности от порядъка на 10-23 до 10-25 грама и да се работи с тях е крайно неудобно. Ето защо Далтон възприел една чисто "химична единица" - атомната маса на най-лекия химичен елемент водорода, спрямо която били определяни атомните маси на останалите елементи.
Впоследствие в"водородната единица" се оказала неудобна и към 1906 година била възприета "кислородната единица", равна на 1/16 от атомната маса на обикновения кислород, равна на 16,0000. Така че атомната маса на един химичен елемент представлява числото, което показва колко пъти атомът на този елемент е по-тежък от 1/16 част от атомната маса на обикновения кислород, приета за 16,0000. С кислородната единица се оперираше дотогава, докато не се оказа, че обикновеният кислород е смес от три изотопа - O16, O17 и O18. Поради това, че за редица въпроси, свързани със спектрите, с ядрените процеси и прочие общоприетата "кислородна единица" се оказала неудобна, предложи се да се вземе за основа атомната маса на лекия изотоп на кислорода - O16, приета за 16,0000. Дойде се до две атомни скали "химичната" с 1116,0000 от атомната маса на обикновения кислород (с трите изотопа) и физичната маса на обикновения кислород по физичната скала се оказа, че е равна на 16,0044. За да се избегнат неудобствта от съществуването на две "кислородни единици" през 1959 се прие за основа на атомните маси на химичните елементи да се вземе въглеродът - изотопът на въглерода е с атомна маса 12,0000. При тази "унифицирана" въглеродна скала атомните маси на химичните елементи на база "химичната кислородна единица" претърпяха извънредно малка промяна. Кислородът с атомна маса 16,0000 придоби стойност 15,9994, водородът от 1,0080 стана 1,00797, хлорът от 35,457 стана 35,453 и прочие.
Молекулите, независимо от колко атома са изградени, имат молекулни маси - сбора от атомните маси на броя атоми, който се включва в молекулата на съединението. Така че молекулната маса на дадено химично съединение представлява числото, което показва клко пъти молекулата на това съединение е по-тежка от 1/12 част от атомната маса на въглерода - 12,000.
Как се дефинира молекулата и атомът понастоящем?
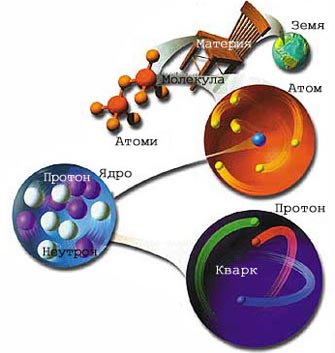
Молекулата е най-малката частичка на веществото, която може свободно да съществува и не може да се дели по-нататък, без да се променят основните свойства на даденото вещество.
Атомът е най-малката частичка на химичния елемент, която се включва в молекулата на простите и сложните вещества и се изявява израз на свойствата на този елемент.
Молекулите на едно и също вещество са еднакви помежду си. Те могат да бъдат едноатомни, двуатомни и прочие, и многоатомни - при белтъците до няколко стотин атома от няколко елемента. Имат много малки размери. При предпоставката, че са сферични, диаметърът им е от порядъка на стомилионни части от сантиметъра.
Молекулите на веществата не са замръзнали в пространството, а се намират в непрекъснато движение, което преди всичко зависи от температурата. При газоете то е постъпателно, зигзагообразно, с почти непредпочитани посоки в пространството, при течностите постъпателно, зигзагообразно с предпочитани донякъде посоки в пространството, при твърдите вещества осцилационно около дадени точки, възли в пространството, изграждащи така наречената кристална решетка. Не всички молекули при газовете са еднакво енергитично богати - имат еднакви скорости на движение. Едни от тях притежават много малки или пък много големи скорости. Големият процент молекули притежаа най-вероятна, най-предпочитана скорост на движение.
На таблица 1 е дадено разпределението на скоростите на молекулите на кислорода за температура 00C.
Таблица 1
Кислород
| Интервал от скорости в m/s | % от общия брой молекули |
| 0-100 | 1,4 |
| 100-200 | 8,1 |
| 200-300 | 16,7 |
| 300-400 | 21,5 |
| 400-500 | 21,3 |
| 500-600 | 15,1 |
| 600-700 | 9,2 |
| Над 700 | 7,7 |
В случая говорим за така наречената Макселова крива за разпределение на скоростите. Като се има предвид големият брой молекули в 1cm3 газ, голямата скорост на движение,зигзагообразния път на молекулите следва, че броят на ударите между молекулите на газа ще бъде извънредно голямо. Средно взето той възлиза на 109 за една секунда. За течностите разпределението на скоростите на движението на молекулите в общи черти съвпада с това при газовете. Онези молекули при течните системи, които са "ненормално" енергитично богати, тоест притежават големи скорости, определят налягането на парите на съответната течност.
Химично сродство
Това понятие, известно в Средновековието като "афинита" всъщност представлява способността на веществата да реагират помежду си. Първоначално се е смятало, че за негова мярка може да служи скоростта на химичната реакция, а впоследствие - топлинният положителен ефект на реакцията. Но след като се установило, че имаме процеси с поглъщане на топлина, равновесни процеси и прочие, редица изследователи подчертали, че нито скоростта на реакцията, нито топлинният й ефект могат да служат като мярка за химичното сродство. Понастоящем за негова мярка е възприета максималната работа, която може да произведе химичнта реакция. За нейното определяне са развити съответни методи, при които се измерва например електродвижешото напрежение и други, но не и топлината.