За първа класификация на химичните елементи може да се сметне разделянето на веществата от Бойл на елементи и съединения. През втората половина на 18 век нроят на химичните елементи нараснал на 34 и Берцелиус (1815) ги разделил върху основата на техните химични и физични свойства на метали и неметали (металоиди). През 1829 г. Дьоберайнер обединил елементите в групи от по три елемента, така наречените триади. Оказало се обаче, че в тях някои свойства на елементите и техните съединения били средни аритметични от свойствата на двата крайни елемента. През 1862 г. де Шанкуртуа, като разположил известните 50 елемента по винтова линия (подредени по възходящи атомни маси), описана върху цилиндрична повърхност, показал, че сходните по свойства елементи се разполагат един под друг. През 1863 година Нюлендс подредил елементите по осем в седем октави и установил, че всеки осми елеент е аналогичен по свойства на първия елемент - закон на октавите. През следващата 1864 година Л. Майер разположил елементите по тяхната валентност в шест групи. Тука трябва да отчетем спонтанно създалите се природни групи - кислородна, халогенна и други.
Характерно за тези класификации на химичните елементи е липсата на опит да се свържат групите в обща система, наблюдаваната близост в свойствата на елементите се е отдавала на случайността, на елементите се е гледало като на самобитни системи, нямащи нищо общо помежду си, в недомлъвка се е подчертавало, че е налице някаква връзка между атомни маси и свойствата на химичните елементи, не всички подреждания са били екзактни, в някои случаи е имало големи противоречия, липсвал е опит за някаква по-задълбочена интерпретация на тези подреждания и други.
Откриване на периодичния закон и изграждане на периодичната система от Менделеев
Като приел, че атомната маса на химичния елемент е "такова свойство, от което зависят всички свойства... свойство, което остава неизменно при всички негови съединения, присъщи на елемента", Менделеев формулирал периодичния закон както следва (1869-1871) : "свойствата на простите тела (елементите), а така също и типовете и свойствата на съдиненията на елементите се намират в периодична зависимост от големината на атомната маса на елементите".
Вижда се от това обобщение атомна маса - свойства голямата мащабност на делото на Менделеев. То далеч надхвърля опитите на всички негови предшественици относно класификацията на химичните елементи.
Впрочем заслугите на този велик руски учен, накратко дадени, се състоят от следното: той е изразил най-ясно и най-пъълно зависимостта между свойствата на химичните елементи и атомните маси, съзрял е, че тази зависимост не е правило, а природен закон с най-голяма обхватност, убеден дълбоко в тази зависимост-закон е дошъл до следствия, до които никой от неговите предшественици не бил достигнал, резултат на екзактността на закона, коригирал атомните маси на някои елементи и предсказал съществуването на неоткрити елементи, подчертал, че разликата между свойствата на химичните елементи не е външна, случайна, а връзка, която дълбоко се корени в същността на химичните елементи и окончателно наложил периодичния закон в науката.
В какво се изразява всъщност периодичността?
Ако излезем от елемента Li с атомна маса 6,9 и подреждаме хоризонтално елементите по възходящи атомни маси: Be - 9,0; B - 10,8; C - 12 и прочие, и приемем, че свойствата им се променят монотонно, идваме до F с атомна маса 18,9, след което следва Na с атомна маса 22,9. Този елемент вместо да притежава свойства, които по възходящия ред атомни маси да следва монотонността, неговите свойства се връщат обратно към Li - явяват се аналогични на свойствата на Li и така нататък.
Дълбоко убеден в своето откритие, Менделеев дава израз на периодичния закон в лицето на периодичната система на химичните елементи. Първото подреждане той е съобщил през 1869 година, а впоследствие при по-съвършено подреждане на химичните елементи през 1870 година е дал вариант, който е много близък до днешния.
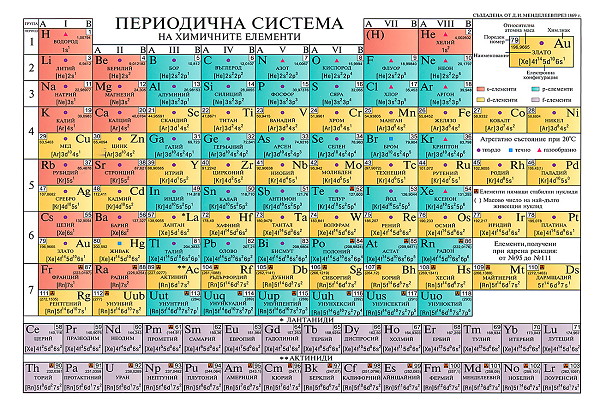
Периодичната система на химичните елементи в днешния си вид е изградена от 9 групи, включително нулевата група, 7 периода и 10 реда. Мястото на елемента в системата е поредният (атомен) номер. Очевидно тя е плоскостна - двудимензионална. В първия период са два елемента (H и He). Във втория и третия период и същевременно редове се намират по три елемента. Тези три периода съставляват малките периоди на системата. Четвъртият, петият и шестият период са дългите периоди. Те са завършени, изградени от четен и нечетен ред - четвъртият период от четвърти и пети ред, петият - от шести и седми ред и шестият - от осми и девети ред. Седмият период често пъти се отбелязва като незавършен. В него се намира десетият ред. Групите от своя страна са разделени на две подгрупи - главна подгрупа, в която са включени елементи от четни и нечетни редове включително елементите от малките периоди и вторична подгрупа - останалите елементи от редовете без елементите от малките периоди. При двете подгрупи елементите, включени в тях, са изместени една спрямо друга. В първата и втората група вторичната подгрупа е изместена вдясно, а в третата и следващите групи в лява посока. Появата на вторичните подгрупи започва от четвъртия период или четвъртия ред с елемента Sc (пореден номер 21). В шестия период, трета група в клетката на елемента с пореден номер 57 - La, става натрупване на 14 елемента, поставяни обикновено под периодичната система, като лантаниди (лантаноиди, редки земни елементи), в седми период, трета група клетката на елемента с пореден номер 89 (Ac) също 14 елемента известни като актиниди (актиноиди). При тях разликата в свойствата е относително най-малка. Осмата група е изградена от три триади (елементи, включени в 4-ти, 5-ти и 6-ти период - четни редове. В нея главна подгрупа няма. По своите отнасяния тези елементи са по-близки до отнасянията на елементите от вторичните подгрупи. Нулевата група, която не бе известна за времето на Мелделеев, обикновено се поставя след осмата група, като първите три елемента He, Ne, Ar се намират последователно в 1-ви, 2-ри и 3-ти период, а последните три - Kr, Xe и Rn в 4-ти, 5-ти и 6-ти период в нечетните редове. В нея няма подгрупи.
Като се вземе предвид казаното, вижда се, че периодичната връзка атомна маса - свойства, не е така проста. Докато през първите периоди (2-ри и 3-ти) периодичността се повтаря без първия период през 8, при 4-тия и 5-тия период - през 18, при 6-тия - през 32 елемента. В нея намират място цялостно и природните групи кислородната, азотната, алкалната и прочие, което говори, че тя е периодична система и на природните групи.
Понякога в периодичната система се излагат и типовете кислородни и водородни съединения. Оказа се, че типът окис за 1-ва група е R2O, за втора - RO, за трета - R2O3, за четвърта - RO2 и прочие, а на седма - R2O7. За водородните съединения (хидридите) за първа група типът е RH, за втора -RH2, за трета - RH3, за четвърта RH4 и прочие. Общо взето максималната положителна валентност (спрямо кислорода) отговаря на номера на групата, а максималната отрицателна валентност (спрямо водорода) се изменя така, че от 4-та група неметалите се явяват четиривалентни, в 5-та група - тривалентни, в 6-та група двувалентни и в 7-ма група едновалентни. R представлява химичният елемент.
Поради това, че от ляво на дясно металните свойства на елементите общо взето отслабват за сметка на неметалните (металоидните) свойства, за очакване е, че те в четните редове ще бъдат по-застъпени отколкото в нечетните. Като се има предвид това, следва че елементите с изразен метален характер се намират в долния ляв ъгъл на периодичната система (Cs и Fr), а тези с подчертан неметален характер в горния десен ъгъл (F и Cl). По диагонала B-W се намират елементите с изразени метални и неметални свойства (As, Bi, Ge, Sb и други).
Изучи се конкретно промяната на немалко на брой свойства (химични и физични) на химичните елементи в зависимост от мястото им в периодичната система - атомната маса. Без да се излагат подробности, това е атомният обем, оптични спектри, цвят на йоните и атомите, йонни радиуси, йонизационен потенциал, валентност на елементите, външен вид, свиваемост на твърдите елементи, кристална форма, електро- и топлопроводимост, магнитни отнасяния и други. Резултатите показват явна периодичност в промяната на тези свойства от атомната маса или екстремум в тези конкретни зависимости.
Някои следствия от периодичната система
Въз основа на периодичния закон и неговия израз - периодичната система, Менделеев е направил изводи, до които никой от неговите предшественици не е бил дошъл. Той е коригирал атомните маси на Be, In, V, Th, Cs, Ce и прочие. Но най-голямото, величаво негово постижение е било предвиждането ан редица химични елементи и определянето на някои техни свойства. Това са елементите Ge, Ga, Sc, Re, Hf и други. На първите три елемента, наречени от него съответно екасилиций, екаалуминий и екабор определил въз основа на периодичната система някои свойства, както и някои техни съединения. "Ека" на санскритски език означава "един" или първи. Смисълът на екасилий е "първият аналог" след силиция. След откриването на тези елементи експериментално цифрово определените свойства, сравнени с предсказаните цифрово дадени от Менделеев, имало поразително съвпадане. Това се вижда от таблица 2 за елементите екаалуминий (галий) и екасилиций (германия).
Тези елементи бяха открити - галият от Льокок дьо Боабодран през 1879 година, а Германият от Клеменс Винклер през 1885 година.
На тази дейност на Менделеев се даде висока оценка, Винклер пише"... то означава бележито разширение на химичното зрение, гигантска крачка в областта на познанието", Енгелс в "Диалектика на природата отчита: "Менделеев... извърши научен подвиг, който смело може да се постави наред с откриването на Льоверие, изчислил орбитата на още неизвестната планета Нептун". А. В. Раковски, известен физиохимик, отбелязва съвсем основателно: "Аз смятам, че откриването и предсказанията на Менделеев са още по-удивителни. Льоверие и Адамс откриха Нептун, ... базирайки се на общоприетия закон на Нютон. Менделеев откриваше елементи и предсказваше техни свойства, опирайки се на празните клетки в създадената от нео система и базирайки се на закона, открит от него и далеч не от всички признат". И действително периодичният закон в своята цялост с всичките негови следствия не е бил приет от всички учени по времето на Менделеев. Известният химик органик Колвин подчертал пък, че законът на Менделеев имал "грубо приблизителен характер", а Вилхелм Оствалд се изказал, че периодичният закон не е в истинския смисъл на думата природен закон, а периодичната система ненапълно определена класификация".
Несъвършенства на периодичната система и опити за нови подреждания на химичните елементи
Чрез мисълта "периодичният закон очаква не само нови приложения, но и усъвършенствания, подробна разработка и свежи сили" Менделеев подчертал, че изразът на закона не е съвършен. Очертали се редица несъвършенства, някои от които са следните:
- Неустановеното място на водорода. В едни подреждания той се поставя в първа група, над лития, в други в седма група - над флуора. Както за едното, така и за другото поставяне съществуваха основания;
- Наличието на вторични подгрупи нарушава целостта на групите;
- В осма група се включват на три места по три елемента (триади).
- Включването на 14 елемента - лантанидите, в една единствена клетка в трета група на периодичната система;
- Характерният тип висш окис за дадена група невинаги съществува;
- Редът го увеличение на атомните маси навсякъде е спазен. Той е нарушен на четири места - Ar и K, Co и Ni, Te и Th и Pa. Следващите елементи K, Ni, I и Pa имат по-малки атомни маси от съответните предшестващи ги;
- Периодичният закон има качествен по-скоро, а не количествен характер. Не съществува общ математически израз, въз основа на който можем да изчислим частните свойства (химични и физични) на елементите;
- Обозначението е "периодичен закон на химичните елементи", а сравняваме всъщност в таблицата свойствата на простите вещества.
Тези и други несъвършенства подтикнаха редица изследователи към опити за нови подреждания на химичните елементи, при които д се даде по-пълен израз на периодичния закон. И за късо време се явиха огромен брой "периодични таблици" - около 300. Междувпрочем се подчерта, че периодичният закон би могъл по-пълно да се изрази, ако се изгради тридимензиално, пространствено, неплоскостно подреждане на химичните елементи. Постави се въпросът за "пространствени периодични системи". И такива се дадоха няколко.
Понастоящем периодичният закон, свързан с поредения номер на елемента или строежа на атома като цяло, несъвършенствата на периодичната система Менделеев се изясниха, включително и смутът, който се внесе с откриването на благородните газове (He, Ne и други). И тъй като всяко ново подреждане на химичните елементи притежава свои, специфични несъвършенства се оказа, че Менделеевата периодична система понастоящем се явява най-задоволяващата. Във връзка със строежа на атома се даде и така наречената разгъната периодична система на Менделеев (длинно периодичньй вариант), в която лантанидите, както и актинидите намират своето място.
Научна стойност и значение на периодичната система
Откриването на периодичния закон и създаването на периодичната система на химичните елементи се явиха мощен стимул за много по-бързото развитие на химичната наука.
Показа се, че връзката между свойствата на елементите върху основата на атомната маса не е случайна, не е външна, а дълбоко се корени в природата, същността на елементите. Това говореше двусмислено, логично, че "простите неделими атоми" не са неделими, а притежават свой собствен строеж, в който участват частици, общи за всички елементи.
Чрез периодичната система бе ярко илюстрирано, че количествените промени в атомната маса водят до качествени изменения в свойствата на химичните елементи. Местата, клетките в периодичната система станаха израз на определени характерни комплекси от физични и химични свойства. При това се оказа, че тяхната промяна от клетка в клетка в хоризонтална и вертикална посока не е непрекъсната, а протича скоково и периодично.
Освен в таблицата ярко намери отражение закономерната промяна на металните свойства в неметалните и обратно. Подчерта се, че няма елементи, които да са абсолютни метали и абсолютни неметали. Всеки елемент е носител на двете групи противоположни свойства и в зависимост от мястото му в периодичната система преобладават или едните, или другите свойства. По този начин Менделеевата система се явява образцов пример на противоположностите, включени в едно единство - химичния елемент.
Периодичната система се яви "теоритичен" апарат за корекция на грешно определени атомни маси, на валентностите на някои елементи и особено в предсказването на нови, неоткрити химични елементи. Върху нейна основа Нодак и Таке (1925) предсказаха свойствата на елемента протактиний, Костер и Хевеши (1930) откриха елемента хафний в цирконовите руди, тя даде първични данни относно съществуването на благородните газове, освен това, свързана със строежа на атома, очерта броя на химичните елементи (Сиборг, 1969), на елементите с поредни номера 114, 117, 118 и други се предсказаха някои свойства, оказа се мощен инструмент в разработката на химията на металите и металните сплави и прочие. Периодичният закон и система имат и голямо философско значение. Те се явиха средство за опознаване на окръжаващата околност и законите в нея.
Всичко това говори за огромното значение на постиженията на Менделеев. Законът и системата се явяват едно от най-великите открития в историята на химията. Това е квинтесенцията на химичната наука. Нилс Бор подчерта, че това е "пътеводната звезда на изследователите в химията, физиката, минералогията, техниката". Подобно на Ариадната нишка, извела героя на древногръцката митология Тезей от лабиринта, така и периодичният закон позволи да се "разглоби" сложният по строеж атом, да се реши един въпрос много по-сложен, отколкото легендарния лабиринт.
Интересно е, че след налагането на периодичния закон в науката, възникна въпросът за приоритета в откриването на закона. Открила се е остра, гореща дискусия в научния печат между някои предшественици на Менделеев и самия Менделеев. В края на краищата благодарение на обективното становище на редица изтъкнати учени за онова време - Браунер, Винклер, Рамзей и други, които подчертали, че дейността на Менделеев е далеч прогресивна, много по-плодовита, следва да се приеме, че откривателят на периодичния закон и периодичната система на химичните елементи е великият руски учен Д. И. Менделеев.