До края на 19 век още от времето на Демокрит и преди него господстваше убеждението, че най-малката частица, последният предел на делимост на материята е атомът. Химичните процеси се разглеждаха като процеси на образуване и разлагане на молекулите, при което атомите остават неизменни. Но дойдоха първите сериозни данни и доводи, които говореха убедително за сложната структура на атомите.
- Периодичният закон и система на химичните елементи - Менделеев подчертал с безспорна яснота, че връзката между свойствата на елементите и атомната маса не е случайна, а дълбоко се корени в същността на атома. Чрез това той предугадил неговата сложност.
- Катодните лъчи - отдавна беше известно, че при преминаване на ток с високо напрежение през разредени газове в подходящо конструирани стъклени тръби се получава сноп от лъчи от катода към антикатода, наречени катодни лъчи (В. Хиторф, 1869). Подробните им изследвания в крайна сметка показаха, че това са отрицателно заредени частички (електрони), свойствата на които не зависят от природата на катода и антикатода, както и от природата на разредения газ. Подчерта се впрочем, че те се "отцепват" от атомите на катода, по-малки са от атома и следователно участват в неговото разграждане.
- Радиактивността - подробните изучавания на френския физик Бекерел (1896) , на съпрузите Кюри (1898), на Ръдърфорд и Соди (1903) и други подчертаха, че радиоактивността се дължи на самоволното разпадане на атома на редица химични елементи с голяма атомна маса. Тези елементи се обозначиха като радиоактивни, а явлението на самоволното разпадане, при което се емитират три вида лъчи - радиоактивност. Това са α-лъчи - поток от положително заредени частички с неголяма проникваща способност през метални плочи. В електрично поле се отклоняват към отрицателно заредената плоча. Тяхната маса е равна на масата на хелиевите атоми. β-лъчи - аналогични на катодните лъчи поток от електрони. Като отрицателно заредени те се отклоняват към положително заредената плоча в електрическото поле. Имат относително голяма проникваща способност през метални плочи. γ-лъчи - сходни с рентгеновите лъчи. Имат най-голяма проникваща способност. Не се отклоняват в електричното поле. И трите вида лъчи действат върху фотографската плака.
Тези три фундаметални довода, както и данните около електролизата, недвусмислено и убедително говореха, че атомът е делим, изграден е от частички, едни от които са положително, а други отрицателно заредени. И във връзка с това се постави въпросът как е разпределено положителното и отрицателното електричество в атома, тоест въпросът за атомния модел.
Атомни модели на Томсон и Ръдърфорд и техните слаби страни. Прецизиране на периодичния закон
Първият атомен модел бил предложен от Дж. Дж. Томсън (1903), който приел, че положителното електричество е хомогенно разпределено в целия атом, а отрицателното електричество, тоест електроните плават в това "море от положително електричество", при което се запазва електронеутралността на атома. Този модел бил видоизменен от Ленард, който приел, че в атома съществуват особени силови центри, така наречените динамиди.
Но Томсоновия атомен метод скоро се оказал, че не отразява реално природата на атома. Той бил "атакуван" от Е. Ръдърфорд чрез известния опит: обстрелване на метални пластинки с гама лъчи (положително заредени частички). Върху основата на Томсоновия модел би трябвало всички гама частички да бъдат отразени от металната пластинка, тъй като тя представлява според модела нещо като.плътна завеса от положително електричество (едноименните заряди се отблъскват). Опитът на Ръдърфорд показал, че голяма част от гама-частичките преминават през металната пластинка (било отклонени или неотклонени) и една малка част, статистически взето, една частичка на десет хиляди частички се връщат точно в обратна посока. И за да обясни своя опит, той приел в противовес на Томсон, че положителното електирчество е съсредоточено в центъра на атома като положителното електричество е съсредоточено в центъра на атома като положително заредено ядро, около което по различни орбити кръгово се движат електроните. При това скоростта на кръговото движение е от такъв порядък, че развитата центробежна сила уравновесява елекростатичното привличане между ядрото и електроните. Лансиран бил "планетарният модел" на атома (1911), наречен така понеже по структура наподобявал Слънчевата система (Слънцето като ядро, около което кръжат планетите). При този модел във висша степен участва "празното пространство между атомното ядро и електорните, през което пространство преминавали гама-частичките при обстрела на металната пластинка с гама-лъчи. Като се има предвид диаметърът на атома около 10--8 см, на електрона 10--13 см, на ядрото 10-12 - 10-14 см и нищожната маса на електрона 1/1836 от масата на водородния атом, следва първо, че масата на атома главно е съсредоточена в ядрото и второ, че строежът на атома в голяма степен е "порьозен". Изчисленията показват, че ако 21 тона платина, които реално заемат около 1м3 се свият до степен, че електроните плътно се долепят до атомните ядра, би се получил обем платина около 1мм3, който ще тежи 21 тона. Разликата между обемите 1мм3 и 1м3 представлява празното пространство.
Първата задача след създаването на планетарния модел на атома била да се определи броят на положителните заряди на ядрото на различните атоми и в съответствие с електронеутралността на атома какъв е броят на кръжащите около ядрото електрони. И във връзка с това Ръдърфорд със сътрудниците си Чадвик, Гайер и Мардсден, като интерпретирали количествено отклонението на гама-частичките, преминаващи през металната пластинка, установили, че броят на положителните заряди на атомното ядро е приблизително равен на половината от атомната маса на елемента. По-нататък се поставил въпросът за зависимостта между заряда на атомното ядро и поредения номер на елемента. Изследвайки последната, между природата на елемента - метал, поставен като антикатод в специално конструирана рентгенова тръба и дължината на вълната на излъчваната монохроматична рентгенова светлина, Мозли (1912) установил, че квадратният корен от реципрочната стойност на дължината на вълната, така нареченото вълново число, се намира в строго линейна зависимост от поредния номер на елементите, обозначаван със z. Тази зависимост е известна в литературата като закон на Мозли. Ако вместо поредния номер се постави атомната маса, поличава се леко лъкатушеста линейна зависимост.
Тези основни зависимости показват първо, че от по-съществено значение за свойствата на химичния елемент се явява пореденият номер на елемента, а не толкова атомната маса и второ, че зарядът на атомното ядро е равен на поредения номер на елемента. Като се има предвид електронеутралността на атома, следва, че броят на електроните около атомното ядро също е равен на поредния номер на елемента, равен на броя на положителните заряди на атомното ядро.
Но независимо от това, че "планетарният модел" дал една по-пълна, по-прогресивна представа в опознаването на строежа на атома, този модел стоял в противоречие с основното положение на класическата електродинамика, че движещият се около ядрото електрон трябва да излъчва непрекъснато енергия под формата на електромагнитно лъчене (видима светлина, ултравиолетова, рентгенова светлина и прочие). Оттук би следвало:
- Скоростта на кръгово движещите се електрони да намалява, електроните все повече и повече да се приближават към атомното ядро и в края на краищата да "кацнт" върху него, при което атомът като постройка да престане да съществува.
- Поради непрекъснатото изменение на скоростта на електрона около ядрото би трябвало електромагнитното лъчене да се състои от непрекъснат ред лъчи с различна дължина на вълната, тоест би трябвало спектърът на водорода да бъде непрекъснат.
Опитът показва, че атомът е устойчив и електромагнитният му спектър не е непрекъснат, а прекъснат.
Теорията на Н. Бор за строежа на водородния атом
С цел да се избягват тези противоречия датският физик Нилс Бор разработил през 1913 г. теорията за строежа на най-простия атом - водородния, в основата на която поставил квантовата теория, дадена от немския физик М. Планк 1900 г.
Тази теория разпростира представата за атомния строеж върху процесите, свързани с енергитични промени. Тя регламентира, че енергията от една система се излъчва и поглъща не непрекъснато, а прекъснато, на отделни строго определени порции, наречени кванти, тоест енергетичното съдържание на системат асе изменя скокообразно на кванти. Величината на кванта, поглъщана или излъчвана енергия зависи от честотата (броя трептения за секунда) и се дава с израза ε=h*v, където h е Планковата константа (6,623*10-27 erg/s), а v - честотата. Вижда се, че късновълновите излъчвания, тоест тези с голяма честота имат голяма стойност на кванта и обратното за дълговълновите излъчвания.
Като приложил тези представи към движението на електроните около атомното ядро, Бор приел следните постулати (съждание без доказателства), чрез които подчинил планетарния модел на квантовата теория:
- Електронът се движи около ядрото по строго определени, дискретни квантови орбити - позволени орбити, произтичащи от квантовата теория;
- Движейки се по тях, електронът не излъчва енергия;
- Атомът поглъща или излъчва енергия, когато електронът прескача от една квантова орбита на друга. При това разликата в енергитичното съдържание на двете орбити (εнач. - εкр.) се или поглъща, или излъчва под формата на квант енергия hv (фотон), който отговаря на лъч със строго определена честота -h*(c/λ), където c е скоростта на светлината, а λ - дължината на вълната.
- Най-близката до ядрото квантова орбита, тоест тази с най-малък радиус, отговаря на най-малкото съдържание на енергия на електрона - на най-устойчивото, нормално състояние на атома. При придаване на енергия отвън електронът прескача в по-отдалечени орбити, при което енергитичното съдържание на атома съответно се увеличава, намира се във "възбудено състояние", което трае от порядъка на 10-8 . При прескачането на електрона от по-отдалечена към по-близка до ядрото орбита се излъчва енергия с различна честота, която зависи от степента на прехода на електрона и отговаря на различни серии на излъчване, съвкупността от които съответства на цялостния оптичен спектър на елемента (на Лайман - ултравиолетовата област, на Балмер - видимата област, на Пашен - инфрачервената област и прочие).
Ако придаденото количество енергия е значително голямо, става просто "изхвърляне" на електрона от електронната обвивка, при което се получава положително зареден йон (протича процес на йонизация). Количеството енергия, което е необходимо за "изхвърлянето" на електрона на орбита, безкрайно отдалечена тот ядрото на атома, се нарича йонизационна енергия. Тя се дава в kcal за грам-атом. За водорода йонизационната енергия е H+313kcal=H+ + e- . Колкото е по-голям зарядът на ядрото, по-малък радиусът на атома, толкова съответно е по-голямо електростатичното привличане ядро-електрон, толкова е по-голяма йонизационната енергия. Често пъти се оперира и с йонизационния потенциал. Той представлява минималното напрежение на електричното поле във волти, при което електронът напуска атома и последният се превръща в йон. Дава се в електроволти (eV). За водорода йонизационният потенциал е H+13,5956=H+ + e-. Йонизационната енергия е свързана с йонизационния потенциал чрез съотношението енергия на йонизацията=йонизационния потенциал, умножен със стойността 23,06. При последователно изхвърляне на първи, втори, трети и прочие електрон говори се за последователни йонизационни потенциали. Първият има най-малка стойност, а последният - най-голяма.
Въз основа на изложените представи Бор изчислил радиусите на квантовите орбити, по които се движи единственият електрон на най-простия по строеж атом - водородния атом, както и тяхното отношение.
Излизайки от равновесието между развитата центробежна сила на кръгово движещия се електрон - електростатично привличане ядро - електрон и приемайки, че радиусите не могат да приемат всякакви стойности, а само строго определени, регламентирани от квантовата теория орбити, при цели числа 1, 2, 3 ... n се получават за n=1, r1=0,53Å, за n=2, r2-2,12 Å, за n=3, r3=4,77Å и прочие. (1Å=10-8cm) или отношението между радиусите r1:r2:r3=0,53: 2,12: 4,77, респективно 1: 4: 9 или 12: 22: 32 ......n2n се обозначава като квантово число.
Електронът се движи по най-близката до ядрото орбита r1=0,53Å със скорост 2200 км/с (за сравнение скоростта на движението на Земята около Слънцето възлиза на 30 км/с), което съответства на 10Å оборота в секунда; космическите кораби Восток 1 и Восток 2 са имали скорост от около 7,5 км/с.
Първата експериментална проверка на теорията на Бор и оттам задържаността на постулатите била направена върху прекъснатия спектър на водорода. Много години преди Бор Балмер (1885) установил експериментално уравнение, засягащо честотата на някои линии. В него фигурирала така наречената Ридбергова константа 3,29 ... 1015 . Бор си поставил за цел да определи теоритично тази константа. При съответна математична интерпретация той изчислил стойност 3,27*1015. Очевидно това почти съвпадане на екеспериментално и теоритично дадена стойност за тази константа било потвърждение на теорията на Бор и преди всичко за правилността на приетите постулати.
Както Ръдърфорд, така и Бор приел, че движението на електрона респективно електроните около ядрото е кръгово. Впоследствие се оказало, че то е много по-сложно.
По реда на отдалечаването на електронните орбити от ядрото, наред с цифровото им означаване 1, 2, 3 ... n (главно квантово число), означават се още и буквено K, L, M, N, O, P, Q; така че K - електронна орбита съответства на главно квантово число - 1, L - на 2, M - на 3... Q - на 7.
Разпределение на електроните около атомното ядро по групи, периоди и редове на периодичната система. Зони на електронната обвивка
Теорията на Бор за строежа на водородния атом впоследствие била разпространена и върху атомите на останалите елементи. И във връзка с това особено целесъобразни в химично отношение се оказали, въпреки тяхната схематичност, моделите, дадени от Косел през 1916 г. Като излязъл от периодичната повторимост на свойствата на химичните елементи в зависимост от атомната маса, валентността, както и реакционната способност на елементите той приел слоестия строеж на електронната обвивка, чрез която единствено могло да се обясни периодичният закон на Менделеев.
Например илюстративно за първите три елемента от периодичната система H, He (първи период), Li (първи елемент от втори период).
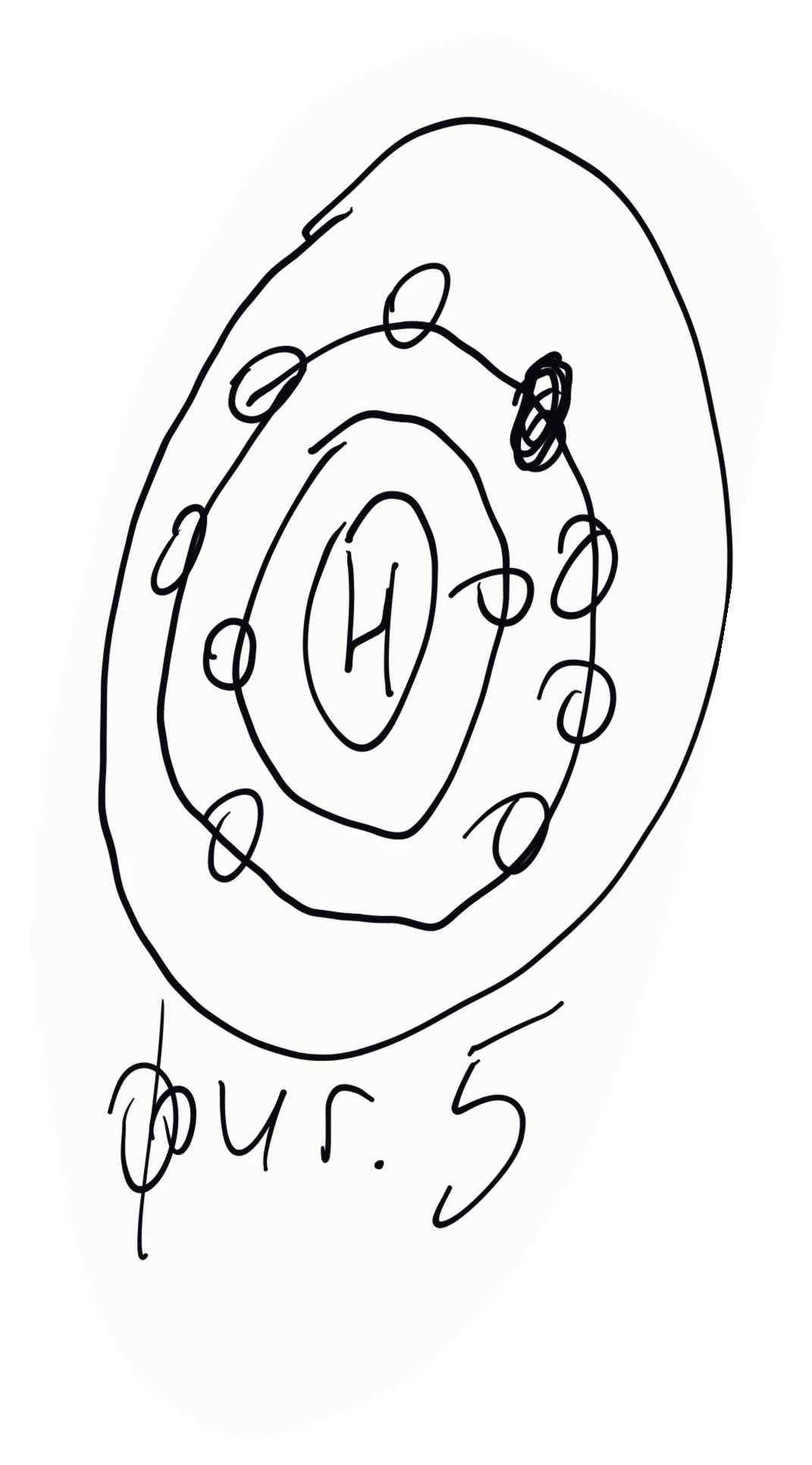
За водорода - на неговия атом може да се даде само един модел - разпределение между единствения електрон и атомното ядро (пртона), даден на фигура 1. В съгласие с химичните отнасяния на водорода този модел следва да се приеме за израз на реакционноспособността на водорода (реакционно способен и едновалентен), тоест че единственият електрон, включен в К-орбитата може да напуща и обратно да се включва отново в атома перифразирано, напущането и включването на електрона регламентира реакционната способност на елемента, а броят "отцепени" електрони неговата валентност.
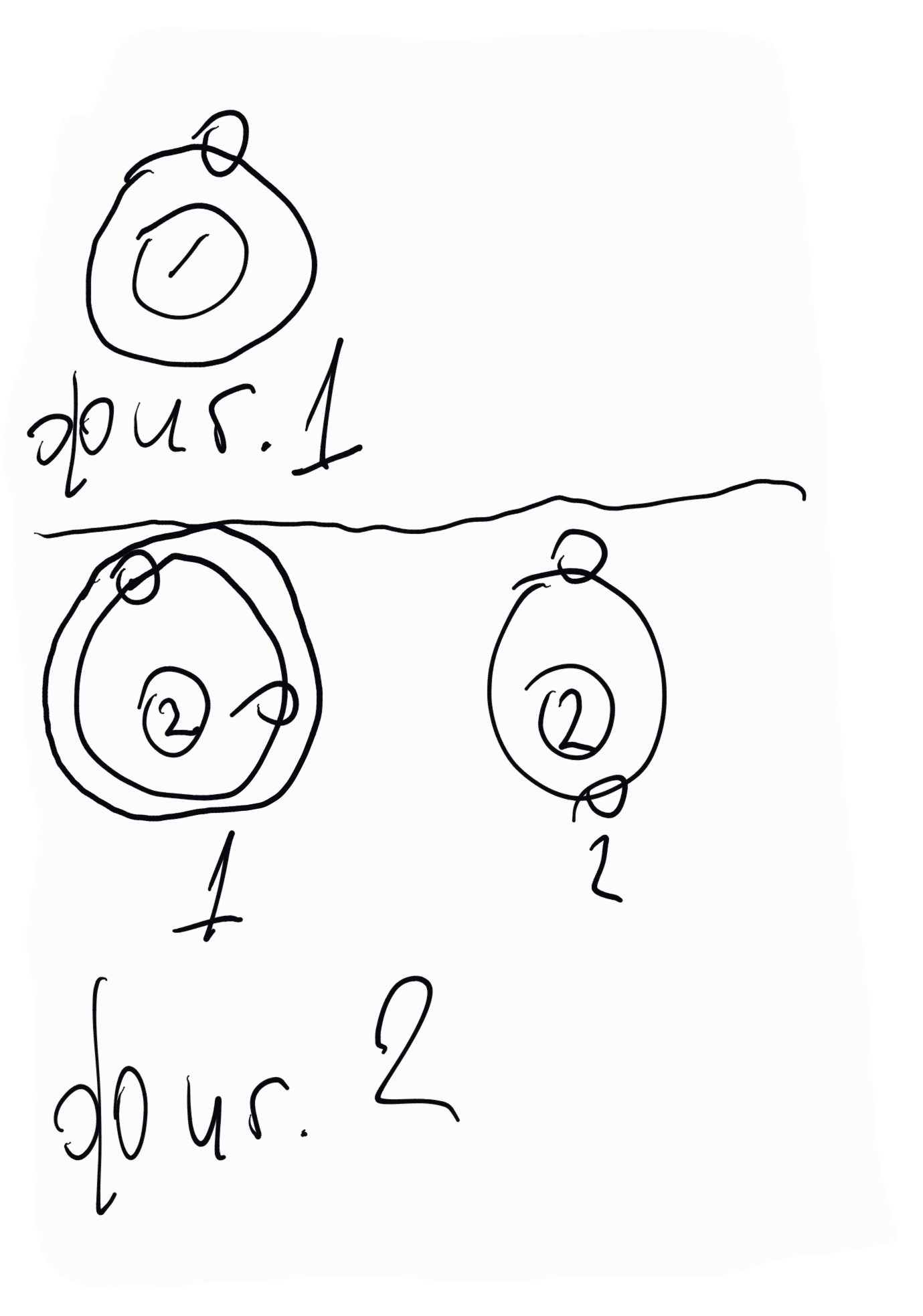
За хелия. На неговия атом могат да се дадат два модела (фигура 2 - вляво).
В съгласие с казаното за водородния атом при модел 1 хелият трябва да притежава известна реакционна способност и да се явява от първа и втора валентност, отдавайки единия или двата електрона. Известно е, че хелият е благороден газ, нереакционноспособен и се явява в нулева валентност. Очевидно модел 1 трябва да отпадне и да остане единствено модел 2 ядро с една електронна орбита (К), в която има два електрона. Това разпределение трябва да се приеме като израз на нереакционна способност; К-орбитата нито може да отдава, нито може да приема електрони - нулева валентност.
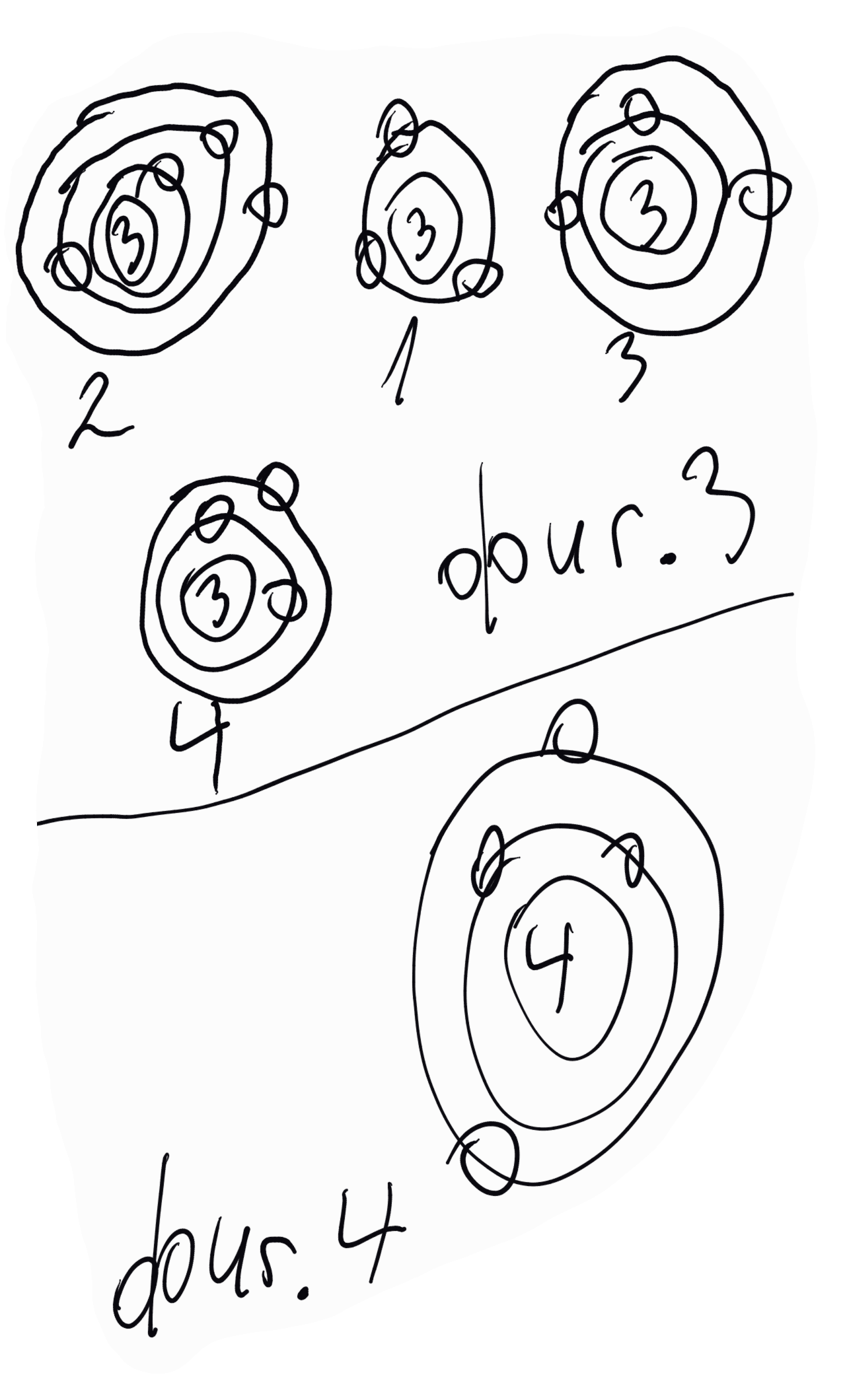
За лития. Литият е е първият елемент на трети период в периодичната система. На неговият атом могат да се припишат четири модела, виж фигура 3 - 1, 2, 3 и 4. Моделът 1 отпада веднага, тъй като, ако се приеме илюстрираното електронно разпределение, трябва да се отчете, че хелият е реактивоспособен, което не отговаря на действителността. Моделът 2 говори, че литият е реакционноспособен и трябва да се явява от първа, втора и трета валентност, тоест в променлива валентност. Моделът 3 отчита реакционноспособността на лития да се явява във втора и трета валентност. Моделът 4 изразява реакционната способност на лития и да се явява само в първа валентност, тъй като при отпадането на най-външния електрон се получава хелиевата конфигурация, за която се подчерта, че е стабилна - нереакционноспособна. Вземайки в съображение действителните отнасяния на лития (реакционноспособен едновалентен елемент), се вижда, че те стоят в пълно съгласие с модел 4 - два електрона в K-орбитата и един електрон в L-орбитата, и още, че се поставя началото на втората квантова орбита, L-орбитата.
При берилиевия атом разнообразието в разпределението на електроните е още по-голямо, но от всички възможни модели, като се вземат в съображение химическите отнасяния на берилия, се вижда, че само моделът на фигура 4 стои в пълно съгласие с тях - два електрона в К-орбитата и два електрона в L-орбитата.
При следващите елементи от втори период B, C, N, O, F, Ne в съответствие с техните химически отнасяния, следва съответният брой електрони да се включат в L-орбитата, която при Ne се запълва с 8 електрона.
За разлика от предхождащите Ne елементи, които са реакционноспособни, явяващи се във валентността, съответстващи на броя електрони в L-орбитата, неонът е нереакционноспособен, нулева валентност, благороден газ.
След него следва, по реда на нарастващата атомна маса Na, първият елемент от трети период на периодичната система. При него 11-тият електрон би могъл да бъде включен като 9-ти в L-орбитата или пък в следващата орбита (М), като единствен електрон.
От тези две възможности първата се изключва, тъй като трябва да се приеме, че неонът е реакционнонеспособен. Остава втората възможност, при която 11-тият електрон поставя началото на нова електронна орбита (М), при което натрият следва да бъде реакционноспособен и да се явява само от първа валентност, което съответства на действителните отнасяния на този елемент (фигура 5).
Така че осемелектронната най-външнолежащата орбита подобно на двуелектронанта орбита при хелия е израз на нереакционната способност, на инертност.
Като се върви в хоризонтална посока в периодичната система, без да се разглеждат повече конкретни случаи, могат да се отбележат следните характерни моменти:
- При елементите от главните подгрупи електроните се включват в най-външната електронна орбита, която приемам максимум до 8 електрона (октет) при благородните газове (Ne, Ar, Kr, Xe, Rn) с изключение на К-орбитата (He) - с 2 електрона (дублет).
- При елементите от вторичните подгрупи електроните се включват в предпоследната електронна орбита (с изключение на K и L), която може да поеме до 18 електрона. Най-външната електронна орбита на тези елементи има най-често два електрона и рядко 1. Тази особеност във включването на електрона започва от прехода Ca-Sc, поредни номера 20-21 (втора-трета група, четвърти период - четния ред). Доизграждането на най-външната електронна орбита до 8 се извършва в нечетния ред на големите периоди, като се започва от четвърта група, нечетния ред, прехода Zn-Ga.
- При елементите с пореден номер 57 - La (шести период, четния ред), се струпват 14 елемента - лантанидите. При тях в реда Ce + La електронът се включва в третата електронна орбита N отвън-навътре, която поема от 18 максимално до 32 електрона. При това положение всички лантаниди имат в най-външната орбита (P) 2 електрона, а в предпоследната (O) - 9, най-често 8 електрона. От елемента Hf в хоризонталния ред Ta, W, Re и прочие се доизгражда O-орбитата от 10 до 18 електрона при Hg, като елементи от вторичните подгрупи. От Hg (шести период, нечетния ред) започва да се попълва в хоризонталния ред Ti, Pb, Bi и прочие. P-орбитата до 8 електрона като елементи на главните групи. В общи черти това се повтаря и при актинидите. Въобще максималният брой електрони, характерни за дадена кантова орбита (до n=4) се дава с израза 2n2. При n=1 броят е 2, при n=2 - 8, при n=3 - 18, при n=4 - 32 електрона.
От казаното дотук могат да се изяснят някои основни положения на периодичната система от гледна точка на разпределението на електроните в електронната обвивка:
- Броят на електроните в най-външната електронна орбита при елементите от главните подгрупи е равен на номера на групата.
- Броят на електронните орбити на даден химичен елемент отговаря на номера на периода.
- Разликата в свойствата между елементите е най-голяма, когато броят на електроните се променя в най-външната електронна орбита, по-малка в предпоследната и най-малка - предпредпоследната. Това обяснява защо лантанидите, както и актинидите, се включват в една единствена клетка на периодичната система.
- Наблюдаваното на четири места нарушение в увеличението на атомната маса отпада, ако се разглежда периодичната зависимост между основата на поредния номер на елемента - положителния заряд на атомното ядро.
- Нарушението на електронеутралността на атома е свързано с отдаване или приемане на електрони, при което се получават йони - в първия случай катиони, във втория - аниони.
- Валентността на елементите е тясно свързана със заряда на йоните - броя отдадени или приети електрони. При това:
а) Отдаването на електрони регламентира положителната валентност. По правило то е присъщо на водородния атом и атомите на металите. При вторичните елементи за валентността са от значение още и електроните от по-вътрешната орбита ("подвалентната" орбита), която може да отдава 1, 2 или повече електрони.
б) Приемането на електрони регламентира отрицателната валентост. Обикновено приемат електрони неметалите - хлор, бром, сяра и прочие, тъй като в най-външната електронна орбита имат спрямо металите по-голям брой електрони и са по-склонни да я доизграждат до осем-електронна орбита, най-стабилната орбита. Спрямо кислорода неметалите отдават електрони и се явяват положително заредени. Хлорът, който е отрицателно едновалентен спрямо водорода, той спрямо кислорода, като отдава (1, 3, 5 и 7) се явява едно-, три-, пет- и седемвалентен, положително зареден йон. - Не всички свойства на елементите или атомите им зависят от поредния номер. Едни свойства - химичните, валентността, атомният обем и прочие, имат периодичен характер и се обощават като периферни свойства, тъй като те се определят от най-външнолежащите електрони в електронната обвивка. Друга група свойства са директно свързани с атомното яядро или близколежащите до него електрони. Те нямат периодичен характер и се обозначават като непериферни свойства. Това е атомната маса, радиоактивните свойства, дължината на вълните на рентгеновото лъчене и други. И във връзка с това понякога се говори за "зони на електронната обвивка" и тяхното отношение към свойствата на химичния елемент. Обикновено се отчитат четири зони.
Зона А) ОБласт на ядрените процеси, радиохимията и радиоактивационния анализ. Това е фактически атомното ядро.
Зона Б) Тя обхваща онази част от електронната обвивка, в която електроннтие равнища са напълно окомплектовани, най-близко лежащи до атомното ядро. Тък са процесите рентгеново излъчване и прочие. С увеличаване на поредния номер, скокообразно, увеличава свите размери атомът - броят на напълно окомплектованите електронни равнища.
Зона В) Включва онези електронни орбити и квантови равнища, които са неокомплектовани и като такива могат да приемат или да отдават електрони. В нея се намират валентните електрони и се отчита като "химична" зона. Тя обезпечава немалко на брой отнасяния на елемента - химичната връзка, металната връзка, окислително-редукционните процеси, термоелектронната емисия, корозия на металите, химичните източници на електрическа енергия и прочие, и прочие. По правило тя обхваща отвън-навътре една и две квантови орбити.
Зона Г) Тя включва свободни, вакантни квантови орбити, простира се от химичната зона навън до области, в които въздействието на атомното ядро става безкрайно малко. В нея попадат при възбуждане на атома валентните електрони. При по-висока степен на възбуждане през нея преминават електрони, при което атомът се превръща в йон. Очевидно тази зона се явява като преход от нормалното състояние на атома до неговото йонизиране. Понякога зоните А и Б се обозначават като атомен скелет.
По-нататъшното развитие на въпроса за състоянието на електроните в електронната обвивка след делото на Бор. Квантово механично интерпретиране на движението на електрона
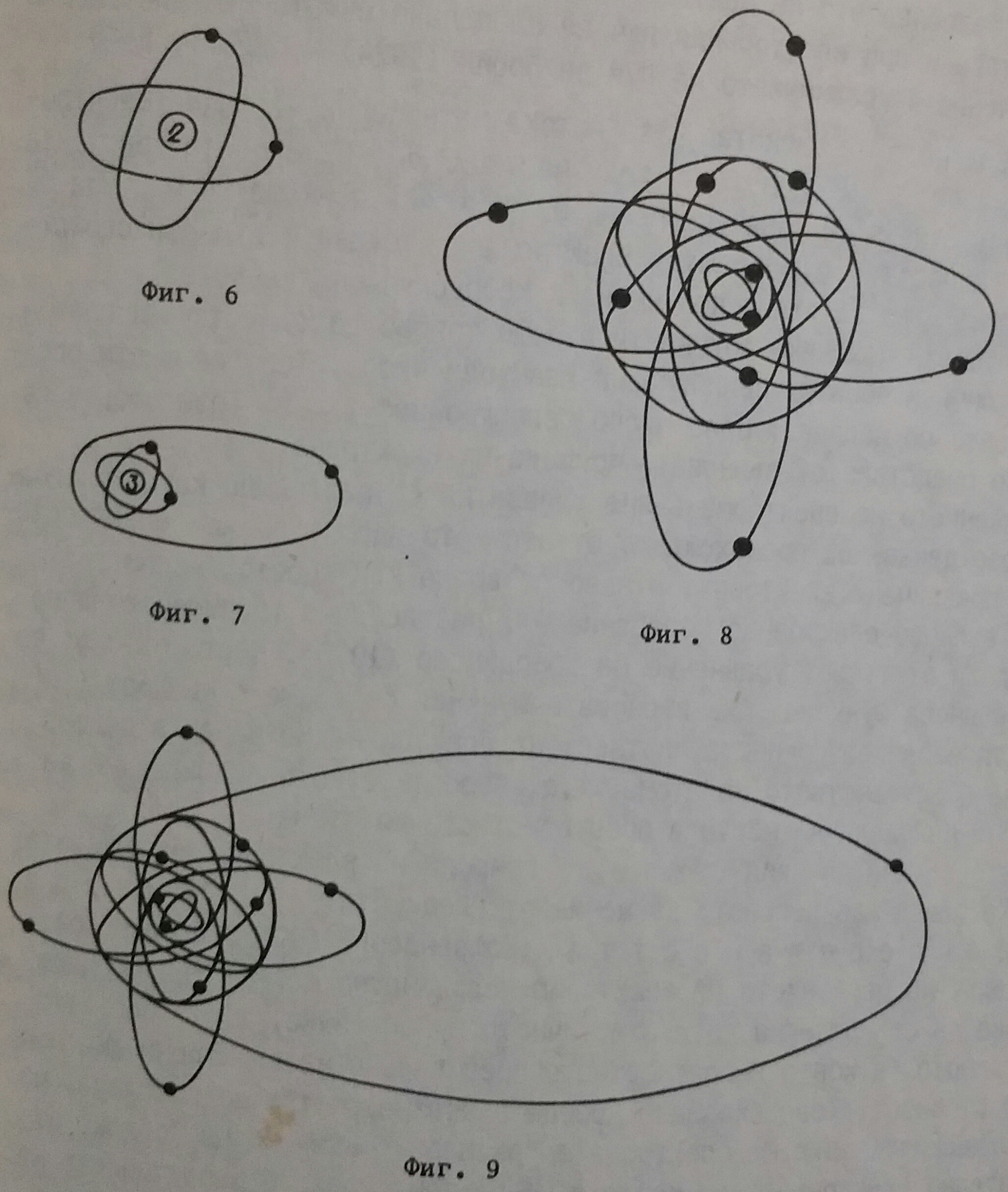 Ръдърфорд и Бор приели, че орбитите на електроните представляват концентрични окръжности около атомното ядро. По-късно (Зомерфелд 1916) подчертал, че всеки електрон има своя собствена орбита, която може да бъде кръгова или елипсовидна, разположена не в плоскост, а в пространството. По такъв начин кръговите орбити се заменили с групирането им по електронни слоеве (K, L, M... Q) енергитични равнища или квантови равнища.
Ръдърфорд и Бор приели, че орбитите на електроните представляват концентрични окръжности около атомното ядро. По-късно (Зомерфелд 1916) подчертал, че всеки електрон има своя собствена орбита, която може да бъде кръгова или елипсовидна, разположена не в плоскост, а в пространството. По такъв начин кръговите орбити се заменили с групирането им по електронни слоеве (K, L, M... Q) енергитични равнища или квантови равнища.
Така, както се изтъква по-горе, водородният атом има ядро и един електрон, който кръгово (К-слоят) се движи около атомното ядро. Последното, лишено от електрона е протонът.
При хелия са налице два електрона, които се движат по две различни кръгови орбити (К-слоя), наклонени в пространството една спрямо друга под известен ъгъл (фигура 6).
При лития има три електрона. Два от тях се движат в К-слоя, кръгово както при хелия, а в третия - елипсовидно, като поставя началото на L-слоя (фигура 7). Той е по-слабо електростатично свързан с ядрото, лесно се "отцепва" и се получава литиевият катион.
Елементите след лития - берилий, бор и прочие, запазват хелиевата конфигурация, като постъпващият електрон се разполага елипсовидно в L-слоя при неона разпределението на 8-те електрона в този слой са симетрично и елипсовидно разположени. Тази симетрия определя стабилност и нереакционноспособност на елемента неон (фигура 8).
При натрия, като се запазва неоновата конфигурация, 11-тият електрон поставя елипсовидно началото на М-слоя (фигура 9). Този електрон, както при лития е слабо свързан с атомното ядро и лесно се "отцепва", като се получава натриевият катион.
При следващите елементи магнезий, алуминий и прочие. М-слоят се запълва елипсовидно до пълна симетричност (при аргона). Тя е стабилна и аргонът се явява нереакционноспособен елемент.
По-сложна е картината при останалите елементи. Но независимо от това, редувайки се несиметричността със симетрично елипсовидно разположените движещи се електрони около атомното ядро, елементите се явяват или реакционноспособни или нереакционноспособни (при благородните газове).
 По-нататък въпросът за движението на електроните се интерпретира от гледна точка на квантовата или вълновата механика. Тази механика регламентира, че законите на движението на електроните има много общо със законите за разпространението на вълните, че както при разсейването на рентгеновите лъчи се наблюдава явлението дифракция, така и при електронния лъч се наблюдава същото явление. Основното уравнение е уравнението на Луи де Бройл (1924) -λ=h/mv, което свързва дължината на λ за потока материални частици (електрони) със скорост V и маса m на тези частици; h е Планковата константа. Физическият смисъл на това уравнение е, че всяка движеща се частица с маса m и скорост V (включително и електрона притежава и вълнови свойства и обратно - всяка вълна притежава и корпускулярни свойства).
По-нататък въпросът за движението на електроните се интерпретира от гледна точка на квантовата или вълновата механика. Тази механика регламентира, че законите на движението на електроните има много общо със законите за разпространението на вълните, че както при разсейването на рентгеновите лъчи се наблюдава явлението дифракция, така и при електронния лъч се наблюдава същото явление. Основното уравнение е уравнението на Луи де Бройл (1924) -λ=h/mv, което свързва дължината на λ за потока материални частици (електрони) със скорост V и маса m на тези частици; h е Планковата константа. Физическият смисъл на това уравнение е, че всяка движеща се частица с маса m и скорост V (включително и електрона притежава и вълнови свойства и обратно - всяка вълна притежава и корпускулярни свойства).
Квантовата механика аргументира защо трябва да съществуват позволени, устойчиви орбити, цели главни квантови числа. Това са онези орбити, на които се наслагат цяло число "електронни" вълни. Тези орбити са неизбежни следствие от вълновата природа на електрона.
Движението на електронна-вълна трябва да се разглежда като пулсиращо вълново движение, произхождащо от атомното ядро и поради електростатичното привличане електронът отново се връща към ядрото. Амплитудата на това вълново-електронно колебание ψ, разглеждано тридимензионално се определя от така нареченото уравнение на Шрьодингер (1926). Често пъти ψ се нарича вълнова функция. Ако вълновата функция се вземе в квадрат (ψ тогава тя изразява средната плътност на електрическия заряд в дадена точка на пространството на атома, тоест вероятностното пребиваване на електрона на различни места в пространството на атома.
Като се има предвид двойствената природа на електрона, квантовата механика разглежда неговото движение от гледишето на принципа на неопределеността (Хайзенберг, 1925), според който характерът на движението на електрона координатно не може да се даде, а трябва да се прибегне до статичното му описание, тоест областта около ядрото, в която вероятностното пребиваване на електрона има най-голяма стойност. Това схващане доведе в крайна сметка до възгледа, че електрическият заряд на електрона е "размазан" във вид на "облак" от отрицателно електричество, който е по-плътен, колкото вероятността н пребиваване на електрона е по-голяма. При водородния атом при главно квантово число n=1 (K-слоя) максималната електронна плътност формира сфера с радиус 0,53Å. При възбуждане на атома съответно сферата с радиус 2,12 Å (L-слоя), главно квантово число n=2, при още по-силно възбуждане - сфера с радиус 4,77Å (М-слоя), главно квантово число n=3 и прочие. при това колкото радиусът става по-голям, толкова съответно електронната плътност (електронния облак) намалява. Това се вижда от фигура 10. Максималните кръгови потъмнявания, които намаляват с отдалечаването на атомното ядро (електронни облаци), очертават областта на най-вероятностното пребиваване на електрона около ядрото. Те впрочем отговарят на квантовите орбити на Бор n=1, 2, 3 и прочие. Фигурата, която формира електронния облак, респективно пространството на тази фигура, се нарича често орбитала.
Както се изтъкна по-горе, Зомерфелд прие, че движението на електрона по енергитичните равнища е елипсовидно. Елипсата има два параметъра - дългата полуос и освен това късата полуос. Квантовата механика приема определено, че изменението им става за разлика от класическата механика скокообразно, тоест квантово. Дългата полуос се изменя така, както радиусът на квантовата окръжност при модела на Бор и се характеризира с главното квантово число n, докато късата полуос се изразява с така нареченото странично (допълнително) квантово число. Много често то се обозначава и като орбитално квантово число и се бележи с l. То характеризира момента на количеството на движението спрямо центъра на орбитата, докато главното квантово число характеризира енергитичното състояние на равнището в полето на ядрото и се извежда от второто чрез израза l=n-1.
Например при n=3l добива стойностите 1-1=0; 2-1=1; 3-1=2, тоест имаме три орбитални квантови числа, които характеризират формата на съответната орбита или електронния облак. При първата стойност (0) формата е кръгова, а при последните две (1 и 2) елипсовидна, така че при главно квантово число n=3 имаме една кръгова и две елипсовидни орбити или една сфера и два елипсоида. При това колкото по-голяма е стойността на l, толкова съответно е по-голям ексцентрицетът на елипсата (елипсоида).
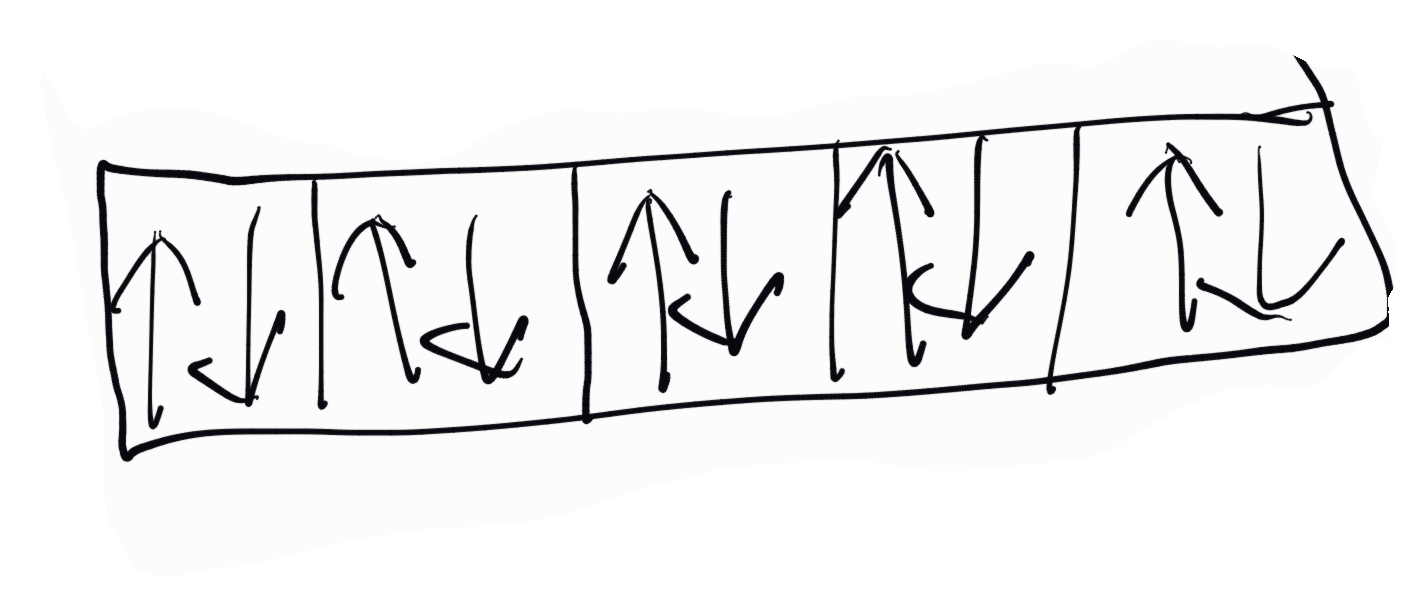
В електрично или магнитно поле спектралните линии търпят известно раздвожение (ефект на Зееман, 1896 или ефект на Щарк, 1916), което се означава като мултиплетност на спектралните линии. Този ефект не можеше да се обясни с двете квантови числа и се въведе трето квантово число - магнитно квантово число, отбелязвано с "m". То определя положението на плоскостта на електронанта орбита при една и съща форма в дадено енергитично равнище под влиянието на електрично или магнитно поле, тоест посоката, в която е изтеглен електронният облак. Така че освен стойността това число представлява и вектор. То приема цели положителни и отрицателни стойности, но винаги в границите на орбиталното квантово число - l0 + 1. Така например l=0, кръгова орбита, и m=0, тоест съществува енергитично състояние; при l=3, стойностите за m са -3, -2, -1, 0, +1, +2, +3, тоест възможни са седем елипсовидни орбити и прочие. Въведе се така нареченото спиново квантово число - знак S. То определя посоката на въртене на електрона около собствената му от (спин-електрон) и приема само две стойности: -1/2 и + 1/2, отговарящи на двете възможни посоки на въртене - по часовата стрелка и обратно на нея. Графично се изразява със стрелка нагоре или надолу. Ако два електрона притежават еднавки спинови числа (наприемр -1/2 и -1/2) въртят се в една посока и се отчита "електрони с паралелен спин". При първия случай електроните се отблъскват, а при втория привличат. Съответното графично обозначение е ↑↑ (паралелен спин) и ↓↓ (антипаралелен спин).
Тези четири квантови числа дават по-определена картина на сложните движения, за енергитичното съдържание на електрона в рамките на електронната обвивка, но в никакъв случай не трябва да се смята, че те дават напълно изчерпателни сведения.
Подразделение на енергитичните (квантови) равнища на енергитични подравнища. Електронни формули. Принцип на Паули
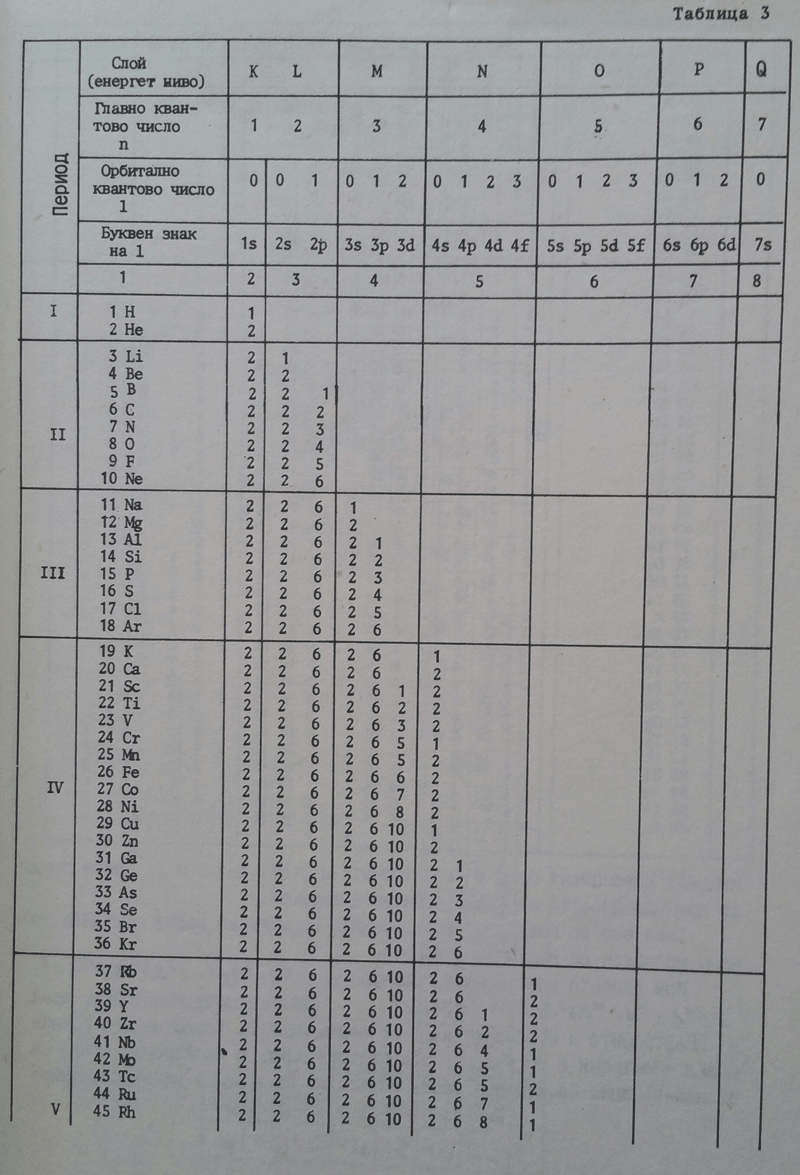
При внасяне на енергия в атома електроните, принадлежащи на едно и също квантово равнище различно се възбуждат - кръгово движещите се по-трудно, отколкото елипсовиднодвижещите се електрони. При последните е от значение и ексцинтрицитета. Това положение показва, че не всички електрони на дадено квантово (енергитично) равнище еднакво електростатично се привличат от атомното ядро. Този факт и други доведоха до заключението, че енергитичните равнища се състоят от енергитични подравнища, отбелязвани най-често с буквите S, p, d, f. Съотношението между главното квантово число n, орбиталното квантово число l и броят на енергитичните подравнища означени с букви е дадено в схемата по-долу:
| K | L | M | N |
| 1 | 2 | 3 | 4 |
| 0 | 0 1 | 0 1 2 | 0 1 2 3 |
| S | s p | s p d | s p d f |
| 1 | 2 | 3 | 4 |
- Главно квантово число n
- Орбитално квантово число l
- Буквено означение на подравнището
От таблицата се вижда:
- В К-орбитата енергитичното подравнище е едно: s; в L-орбитата - две: s и p. В М-орбитата - три: s, p, d; в N-орбитата - четири: s, p, d, f.
- При една и съща стойност на орбиталното квантово число буквеното означение на енергитичното подравнище е едно и също независимо от стойността на главното квантово число (енергитичното квантово равнище). По правило в рамките на дадено енергитично равнище s-подравнището отговаря на най-ниското енергитично състоянием p-подравнището на по-високо, d-подравнището на още по-високо и прочие.
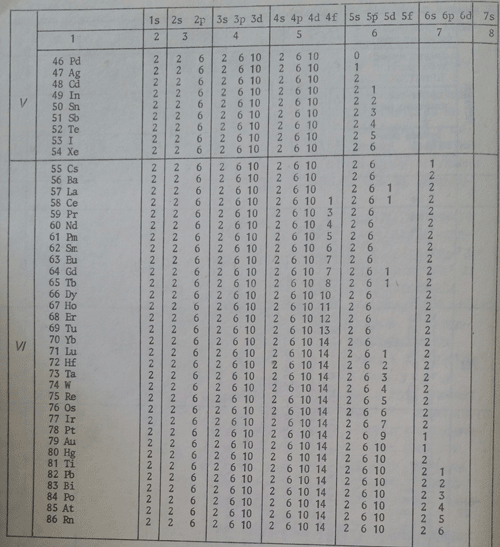
Доколкото максималният брой електрони, които се разполагат в енергитичните равнища, независимо от енергитичното равнище, в s-подравнището е 2, в p-подравнището е 6, в d-подравнището е 10 и в f-подравнището е 14. При това максималното запълване на енергитичните подравнища с електрони в К-равнището, n=1, се намират 2 електрона (1s2), в L-равнището, n=2-8 електрона (2s2 2p6); В М-равнището, n=4-32 електрона (4s2 4p6 4d10 4f14). Следва да се отчете, че при М-равнището започват вторичните елементи, а при N-равнището - лантанидовите елементи.
И във връзка с това честно пъти се говори за s-орбита, p-орбита, за s-елементи (Na, K, Ca, Mg, Sr и прочие), d-елементи (например Sc, V, Mn, Ni и прочие), както за s-електрони, p-електрони и прочие.
Като се има предвид, чеелектроните разположени по енергитични равнища се разпределят по съответните подравнища и второ, че около атомното ядро по Зомерфелд съществуват електронни облаци, дадоха се форми на последните; така s-електроните са в сферичен облак, p-електроните - обемни осморки, d-електроните - розетки и прочие.
Върху основата на казаното при атомните модели на Косел за разпределението на електроните около атомното ядро по групи, периоди и редове на периодичната система и изложеното тук се дойде до изграждането на така наречените електронни формули. При съставянето им се спазва известен ред. Под формата на коефициент се означава числената стойност на енергитичното равнище 1, 2, 3 и прочие, следва буквеното обозначение на енергитичното подравнище s, p и прочие и под формата на показател броят на електрони, който съответства на енергитичното подравнище; той може да бъде максимален, както е отчетеното по-горе или съответно по-малък. Така например 4f8 говори, че електроните се намират в енергитичното равнище N(n=4), заемат f-подравнището и са на брой 8 и така нататък. По такъв начин могат да се изграждат електронните формули на елементите. Например на оловото. Като се вземе предвид мястото му в периодичната система, принадлежността му в главна подгрупа, кои елементи се намират пред него, каква е тяхната електронна конфигурация по енергитични подравнища, електронната му формула е 1s2 2s2 2p 3s2 3p6 sd10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p2. Броят на показателите или техният сбор е равен на 82. Той представлява броят на електрони в електронната обвивка на оловото - поредният номер на този елемент е именно 82.
Практикува се електронните формули да се дават и графично с квадратче, изразяващо орбиталата. Когато то е празно □, орбиталата не е заета с електрони; ако в него има стрелка нагоре, заета е с един електрон. Ако в квадратчето има две противоположно насочени стрелки, съответно нагоре и надолу - орбиталата е заета с два електрона с антипаралелен спин. Например електронната формула на неона графично се представя с 5 квадратчета, във всяко от които има по две противоположни стрелки (виж изображението вляво).
Първото квадратче съответства на 1s2, второто на 2s2, а последните три на 2p6. На таблица 3 е дадено разпределението на електроните по енергитични равнища, съответните квантови числа, орбиталните квантови числа и техните буквени знаци, от която могат да се извеждат електронните формули на химичните елементи.
Таблица 3
В зависимост кое енергитично подравнище се доизгражда, химичните елементи се разделят на семейства. Ако се доизгражда s-подравнището говори се за s-семейство. Например He 1s2, Na 1s22s22p63s12p63s23p4 , също As, Br, Sn, Al и прочие. При тях се доизгражда p-подравнището. При CO електронната формула е 1s22s22p63s23p63d74s2. Тя показва, че s-подравнището е изградено и се доизгражда d-подравнището. Този елемент, както и Fe, Ni, Mn и други принадлежат към d-семейство. Ако се опрем на Pr електронната му формула е 1s22s22p63s23p63d104s24p64d104f135s25p66s2. При него s, p, d подравнищата са изградени. Доизгражда се f-подравнище и този елемент, както и елементите Ce, Tb, Yb и други принадлежа към f-семейството.
Таблица 3, част 2
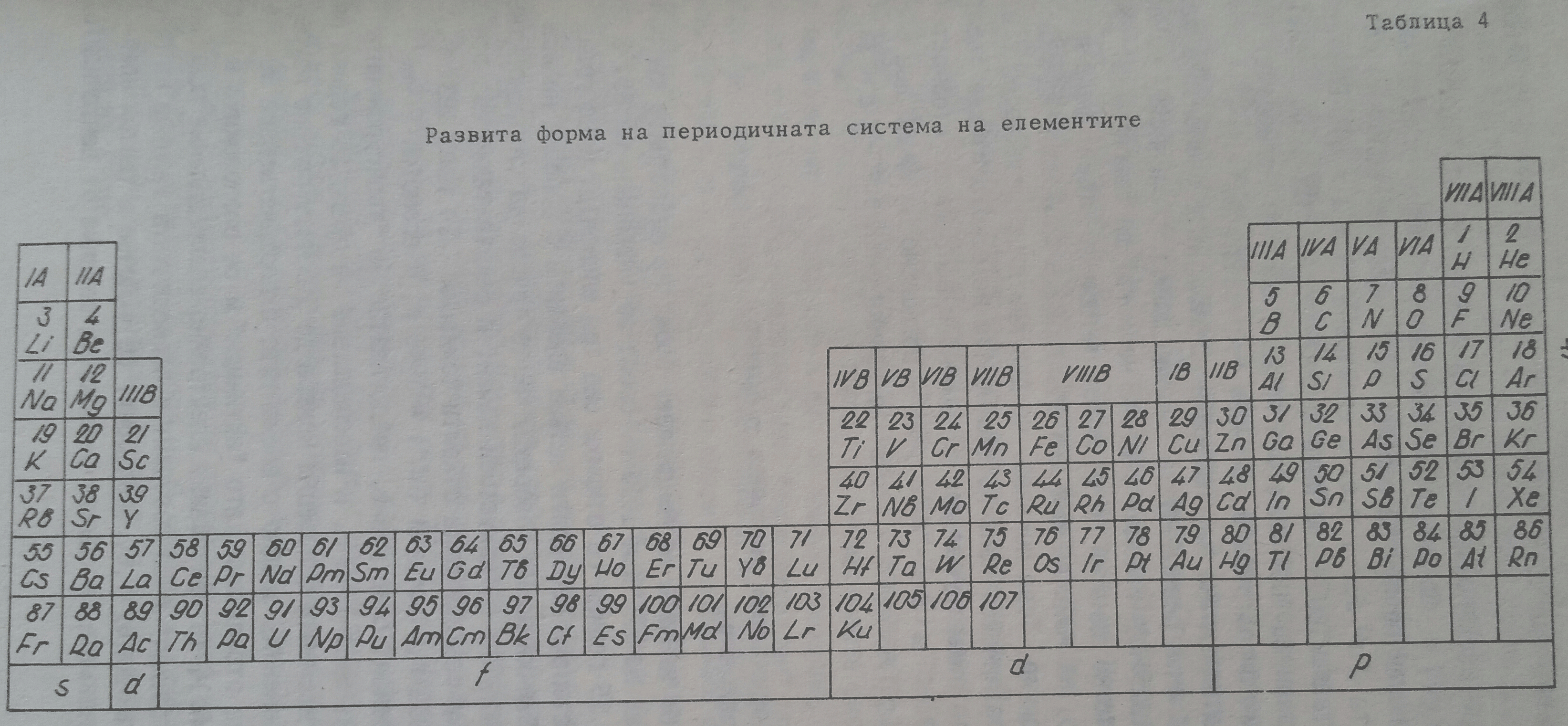
Върху основата на такова разглеждане е развита разгъната периодична система, дадена в таблица 4. В нея с буквата А са означение главните подгрупи (IА, IIА, IIIА и прочие до VIIIА), а с B - вторичните подгрупи (IB, IIB, IIIB и прочие до VIIIB). В тази форма на периодичната система намират място лантанидите, актинидите и неоткритите още елементи, означавани като суперактиниди.
Таблица 4
Върху основата на електронните формули могат да се получат данни по отношение на:
- Принадлежността на елемента към един или друг период на периодичната система върху основата на максималния коефициент прд s-електроните (s-електроните на най-външния електронен слой).
- Принадлежността на елемента към една или друга група на периодичната система върху основата на броя валентни електрони.
- Принадлежността на елемента към главна или вторична подгрупа. Ако валентните електрони са изцяло от външното енергитично равнище, елементът е от главна подгрупа, ако са от две енергитични равнища (външно и по-вътрешно), елементът е от вторична подгрупа.
- Лантанидите и актинидите формират f-семейство. При тях максималният коефициент пред s-електроните е съответно 6 и 7, което говори за принадлежността им към съответните периоди.
Така ако се разгледат електронните формули на двата елемента олово и молибден се получава следното:
При оловото електронната формула е 1s22s22p63s23p63d104s24p64d104f145s25p25p65d106s26p2. Максималният коефициент пред s-електроните е 6, елементът е от шести период. Характерната групировка електрони е 6s26p2. Тя съдържа общо 4 електрона, които са от най-външния електронен слой. Елементът се явява в четвърта максимална валентност, намира се в главна подгрупа в частност в IV А подгрупа.
При молибдена електронната формула е 1s22s22p63s23p63d104s24p65d55s1. Максималният коефициент пред s-електроните от групата 5d55s1, тоест 6 електрона (5+1=6). Елементът е максимално шествалентен и тъй като валентните електрони се вземат от две енергитични равнища (последното и предпоследното) молибденът принадлежи към вторична подгрупа в частност VI B подгрупа.
Подробното анализиране на спектрите на химичните елементи в зависимост от мястото им в периодичната система доведе швейцарския изследовател В. Паули (1925) до извода: В атома не могат да съществуват два електрона с абсолютно еднакви по стойност четири квантови числа или с други думи казано, не може да има два електрона в съвършено еднакво енергитично състояние. Това показва, че два кои да са електрона в атома трябва да се различава поне по стойността на едното от квантовите числа. Не могат да съществуват два електрона с еднакво по стойност n=1, 1=0, m=0 и s=-1/2, но е позволено да имаме два електрона с n=1, 1=0, m=0 и s за единия електрон -1/2 и за втория +1/2.
Граници на периодичната система - броят на елементите
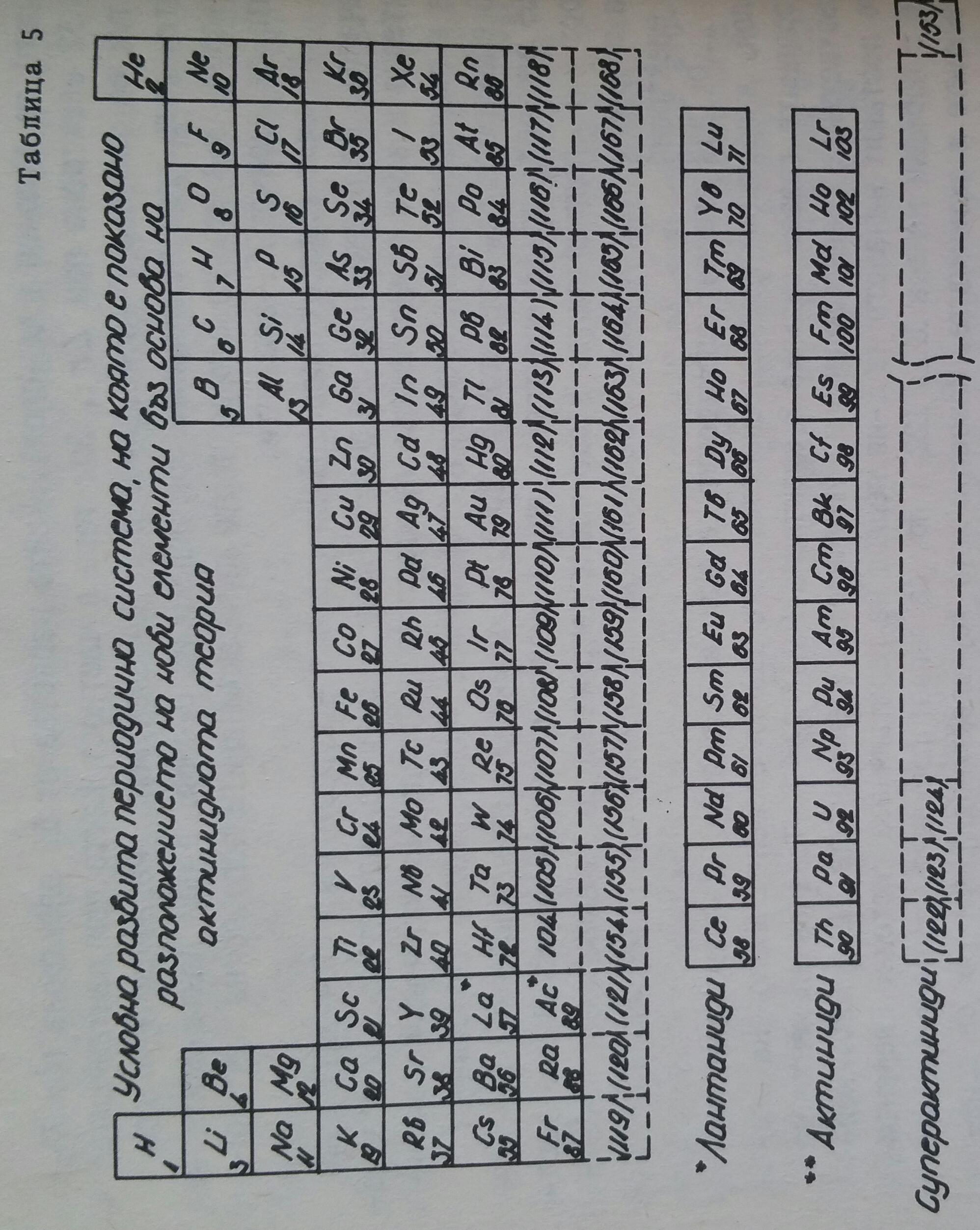
Към 1869 година по времето на Менделеев, броят на извесните химични елементи е възлизал на 62. Към 1910 година броят се увеличава на 85. В продължение на близо 25 години се откриха още три елемента. Пред урана (92-ия елемент) останаха неоткрити четири елемента с поредени номера 43, 61, 85 и 87. Всички данни говореха,че те трябва да са радиоактивни и могат да се получат по изкуствен начин. И действително въз основа на съответни ядрени реакции бяха открити технеций (Tc) през 1937 година, франций (Fr) - 1939 година, астатий (At) - 1940 година и прометий (Pm) - 1945 година. Първият елемент след урана, представител на "трансурановите елементи" бе открит през 1940 година и впоследствие за около 25 години бяха открити редица елементи с поредни номера до 103 включително лоуренсий (Lr). Тези елементи, заедно с елементите с поредни номера 90-Th, 91- Pa и 92 - U бяха отбелязани като "актиниди" и се разположиха в клетката на актиния (Ac). Те притежават електронно разпределение подобно на елементите "лантаниди" и се поставят в периодичната таблица на Менделеев както лантанидите, тоест електронът се включва в третия електронен слой отвън навътре (в случая 0-слоят за разлика от лантанидите, където се включва в N-слоя), който нараства от 18 електрона при Th до 32 електрона при Lr. При това в частност както при лантанидите и тук се запълва f-подравнището до 14 електрона, независимо че при актинидите това подравнище принадлежи на 0-слоя, а при лантанидите на N-слоя. Във връзка с това често пъти актинидите подобно на лантанидите се наричат f-елементи.
Първият елемент след 103-ият елемент - курчатовия (104-ият) дава началото на елементите "трансактиниди", които се редуват до 112-я включително и като принадлежащи на вторична подгрупа, електронът се включва в предпоследния електронен слой именно P-слоя, който нараства от 10 електрона при курчатовия (104), 11 електрона при нилсбория (Ns - 105 елемент) до 18 електрона при елемента с пореден номер 112, в частност в d-подравнището, което поема максимално до 10 електрона. Това са d-елементи. Те имат в най-външния си електронен слой (Q-слоя) 2 електрона.
От 112 елемент електронът се включва в седмиця, Q-електронен слой, в частност 7p-подравнището, като 118-ия елемент, аналог на благородните газове съдържа 8 електрона (7s27p6). Това са елементи на съответните главни подгрупи, включително и елементите 119 и 120, които поставят началото на 8-ия период на периодичната система. Елементите с поредни номера 121, 122 и прочие се явяват преходни, подобно на лантанидите и актинидите. Известни като "суперактиниди" при тях се доизгражда 5g - подравнището до 18 електрона и 6f - подравнището до 14 електрона. На таблица 4 е дадена условно развита периодична система, в която са включени по съответен начин лантанидите, актинидите и суперактинидите, до 153-ия химичен елемент (дадени са и таблици дори до 168-ия химичен елемент).
На известен брой от тези елементи са предвидени, въз основа на периодичния закон и таблица, редица свойства. Така например 114-ия елемент следва да бъде четиривалетен с известна стабилност на атомното ядро: 117-ия да бъде аналог на халогенните елементи, да е с полуметален характер, да се стапя при около 350 градуса по Целзий, да дава нетрайно водородно съединение, а съединенията му с халогенните елементи да показват известна стабилност. 119-ият да е аналог на алкалните метали, да има относително ниска температура на стапяне, дори да е течен за обикновена температура, да се разтваря в течен амоняк, окисът му да е най-основен и прочие.
Впрочем изложеното развитие на въпроса за броя на химичните елементи използва актинидната теория на Г. Сиборг, която има за основа периодичния закон и периодичната система на химичните елементи, както и строежа на атома.
Таблица 5