Въпросът за химичната връзка, тоест силите, които определят свързването на атомите и молекули, е бил поставян още от времето на Далтон. Фактът, че едни вещества се съединяват помежду си, а други не, е накарал древногръцкият философ Емпедокъл да го обяснява с "обичта и ненавистта" на веществата. Ломоносов в своята корпускулярна теория упонадобавял съединяването на веществата със сцеплението между зъбните колела. Бертоле в началото на 19 век отъждествил химичните сили с гравитационните сили, но схващането му бързо отпаднало, тъй като химичните сили са избирателни, а гравитационните сили не. През 1810 година Берцелиус създал електрохимичната теория, в основата на която легнало приемането, че металите са положително, а неметалните отрицателно заредени, и че съединяването на елементите помежду им се свежда до електростатично привличане. Това схващане не могло да обясни образуването на органичните съединения, при които в един случай трябва да се приеме, че въглеродът е положително, а в други отрицателно зареден и, второ, формирането на молекулите на газовете Cl2, N2, O2, H2 и прочие, където следвало да се приеме противоречащото на електростатиката положение, че едноименните заряди се привлича. Особено ценни се оказали теориите на Косел и Люис, създадени през 1916 година и преди всичко последната, която има все по-широк обхват и включва в себе си като частен случай теорията на Косел.
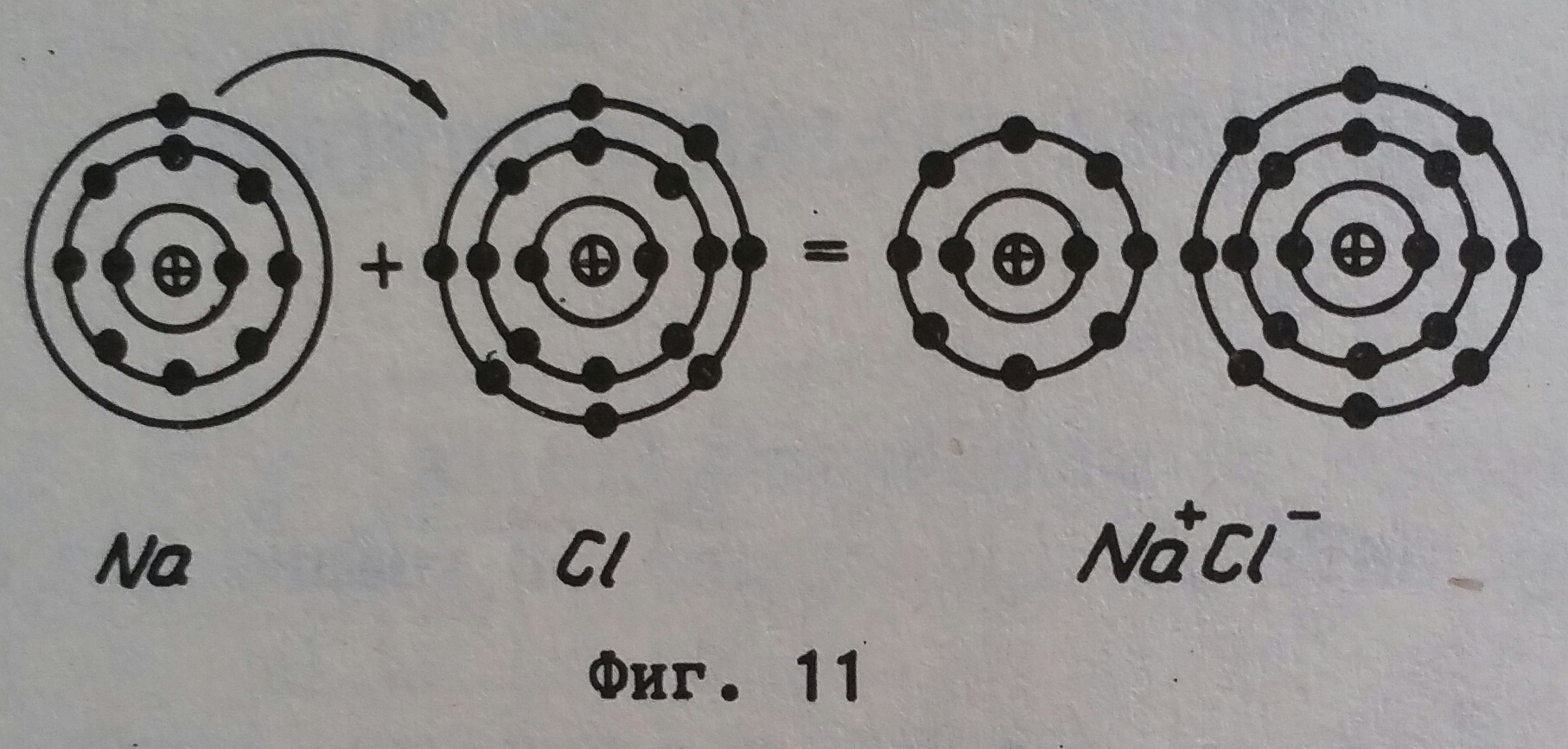
 Косел, като изхожда от факта, че осемелектронният най-външен слой, присъщ на благородните газове, показва подчертана устойчивост, приема, че в хода на химичния процес между елементите, те, по пътя на отдаването или приемането на електрони, "оголват" или "доизграждат" осемелектронен стабилен най-външен слой (октет). Елементтие с малък брой електрони в него (металите и водородът) отдават, а с относително голям брой електрони приемат електрони (неметалите). Така че химичната връзка се свежда до изразено електростатично привличане между формираните и по този начин йони. Илюстративно това е дадено на фигура 11 за елементите натрий и хлор. Но независимо от условията елементите могат да отдават или да приемат електрони, така че казаното няма абсолютен характер. Въпреки простотата и нагледността в механизма на образуването на молекули теорията на Косел има известна ограниченост. Тя не може да обясни образуването на молекули от еднотипни атоми, освен това не всички молекули, особено тези на органичните съединения, са изградени от йони и прочие.
Косел, като изхожда от факта, че осемелектронният най-външен слой, присъщ на благородните газове, показва подчертана устойчивост, приема, че в хода на химичния процес между елементите, те, по пътя на отдаването или приемането на електрони, "оголват" или "доизграждат" осемелектронен стабилен най-външен слой (октет). Елементтие с малък брой електрони в него (металите и водородът) отдават, а с относително голям брой електрони приемат електрони (неметалите). Така че химичната връзка се свежда до изразено електростатично привличане между формираните и по този начин йони. Илюстративно това е дадено на фигура 11 за елементите натрий и хлор. Но независимо от условията елементите могат да отдават или да приемат електрони, така че казаното няма абсолютен характер. Въпреки простотата и нагледността в механизма на образуването на молекули теорията на Косел има известна ограниченост. Тя не може да обясни образуването на молекули от еднотипни атоми, освен това не всички молекули, особено тези на органичните съединения, са изградени от йони и прочие.
По-обхватна се оказа теорията на Люис. В основата й лежи взаимодействието между два електрона с антипаралелен спин. При него магнитните силови линии на породените магнитни полета се свързват помежду си както магнитните силови линии на два разномерни магнитни полюса, при което се образува една по-стабилна и устойчива система. От тази гледна точка Люис обяснява стабилността (нереакционноспособността) на благородните газове, където осемте електрона при антипаралелен спин са свързани стабилно по два посредством магнитните силови линии. Същото е и при хелиевия атом. Ако два еднотипни или разнотипни атома се приближат и притежават електрони с несвързани в рамките на атома полета, при антипаралелен спин магнитните силови линии на полетата се свързват помежду си, като се образува електронна двойка (чифт). Впрочем в това взаимодействие между магнитни полета се състои химичната връзка. Валентността на елементите се определя от броя електрони, които взимат участие в изграждането на електронните двойки.
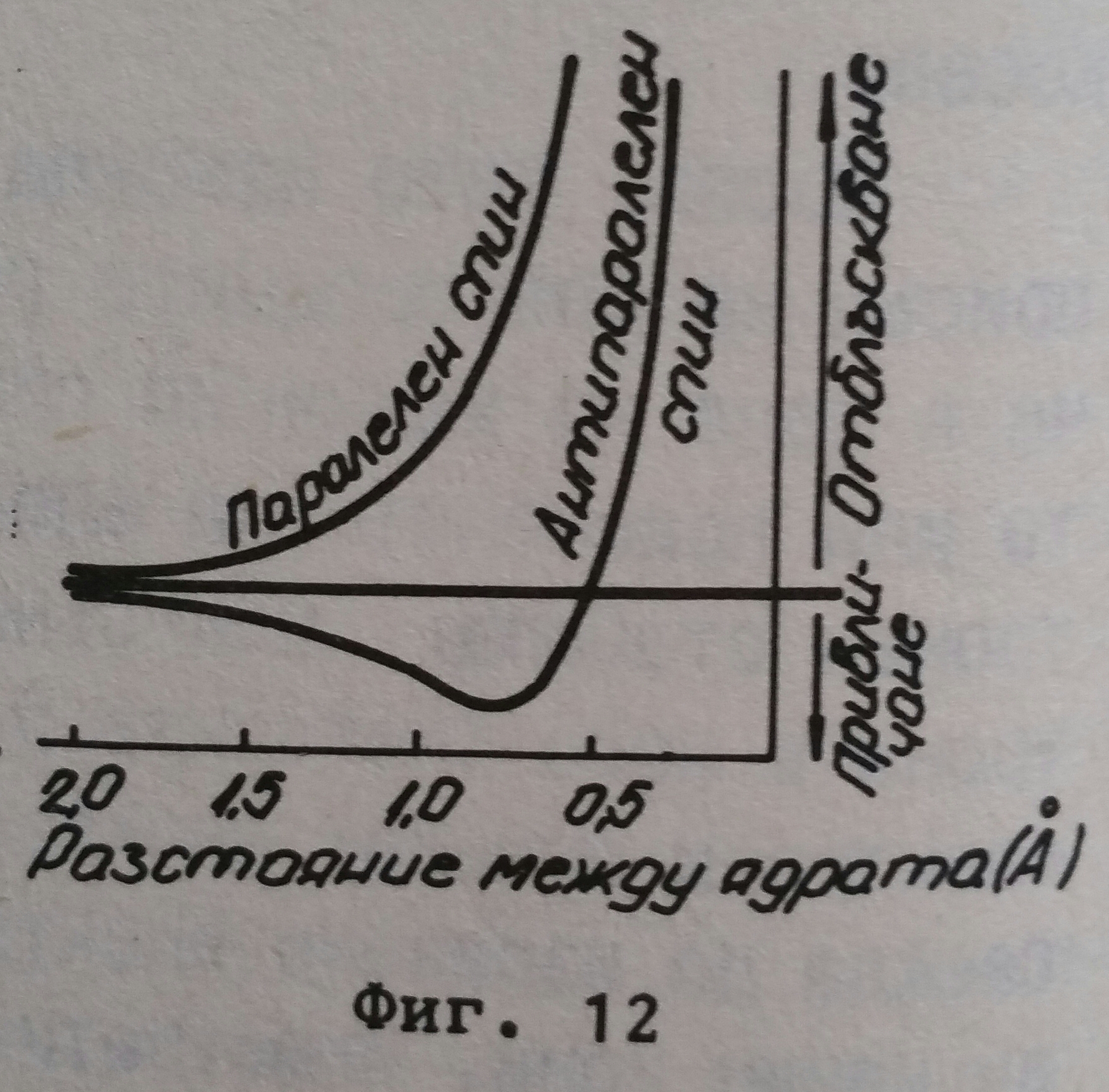
Взимодействието между атоми с паралелен или антипаралелен спин е показано на фигура 12. При паралелен спин със степента на приближаването на двата атома силата на отблъскване се увеличава, а при антипаралелен спин силата на привличането се увеличава, достига известен максимум (при водородни атоми 0,74 Å), след което атомите започват да се отблъскват поради отблъскването на положително заредените атомни ядра. При водорода свързването на атомите в молекули H2 е придружено с отделянето на енергия (105 kcal за грам-мол водород).