На определен етап в развитието на химическата наука пред химиците възникнал въпросът какви са възможностите за разлагането на електронните двойки в рамките на молекулата в зависимост от характера на атомите, тоест какви са граничните видове химични връзки, както и типовете най-прости молекули.
При еднотипни (хлорни, флуорни и прочие) и много близки по свойства атоми, тъй кто те са практически равнозначни, електронната двойка или двойки се разполагат симетрично (еднакво принадлежащи) между двата атома. Например, ако се употребят приетите обозначение Cl: Cl, F: F или пък O::O, N:::N и прочие. Това е типичната неполярна връзка, която е присъща на неполярните молекули. При тях "центровете на тежестта" на разноименните заряди съвпадат в една точка на пространството, тоест при тази връзка и молекули не съществува изразено електрично поле.
При разнотипни, немного различаващи се в свойствата си атоми, електронанта двойка е малко изместена спрямо симетричното положение в посока на атома, който е по-"електронофилен", тоест този, който е с по-голям положителен заряд, притежаващ по-изразена електроноакцепторна функция. Например H:F, H: Cl и прочие или в общия случай A: B "Центровете на тежестта на положителните и отрицателните заряди не съвпадат в една точка на пространството, а се намират на известно разстояние. Това е полярната връзка, присъща на полярните молекули. Тази асиметричност определя появята на два противоположни полюса (положителен и отрицателен) в молекулата и затова често пъти се наричат диполи или диполни молекули.
Във връзка с периодичната система съществуват две правила в изместването на електронната двойка:
- При периодите изместването става от атома на левостоящия елемент към атома на десностоящие елемент: от C към O, от B към F, от P към Cl и прочие.
- При главните групи - от атома на долустоящия елемент към атома на горестоящия елемент - например от S към O, от Br към F и прочие.
Изразеността на полярната молекула зависи от раздалечеността на двата разноименни заряда, тоест от дължината на дипола. Количествено се изразява с така наречения диполен момент Μ=el, където:
- "е" представлява заряда на електрона в електростатични единици (4,80*10-10 електростатични единици), а "l" е дължината на дипола в сантиметри (около 10-8 см). Така че диполните моменти са от порядъка на 10-18. Поради това, че 10-18 се повтаря като постоянна велиичина, прието е тя да се отъждестява с единица и да се нарича дебай (в чест на П. Дебай, холандски физик) и се означава най-често с D. Така CO има М=0,12 дебая; NO=0,13 D; HCl=1,03 D; H2O=1,84 D.
Неполярната и полярната връзка много често се обединяват под общото название ковалентна атомна или хомеополярна връзка. В съответствие с казаното при строежа на атома възниква въпросът как се осъществява ковалентната връзка. Например при водородните атоми. Тяхното енергитично състояние е дадено със съответните атомни орбитали. При приближаването на атомите те се свързват чрез s-електроните с антипаралелен спин, като се образува молекулна орбитала, която изразява химичната връзка и енергитичното състояние на водородната молекула. Формирането на водородната молекула е дадено на схемата:
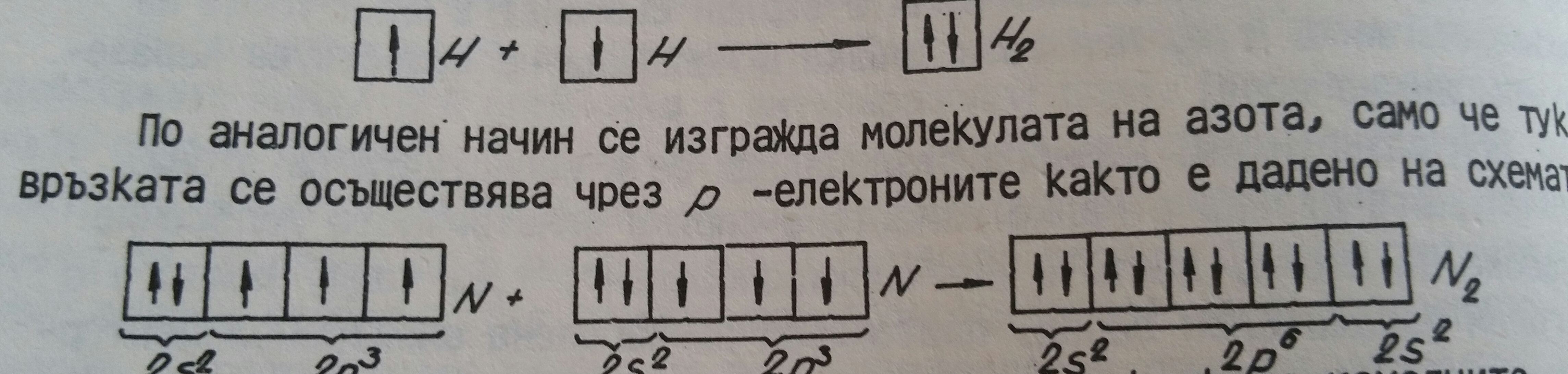
Молекулните орбитали енергитично са по-бедни, отколкото изходните атомни орбитали, тъй като при формирането на връзката се отделя енергия.
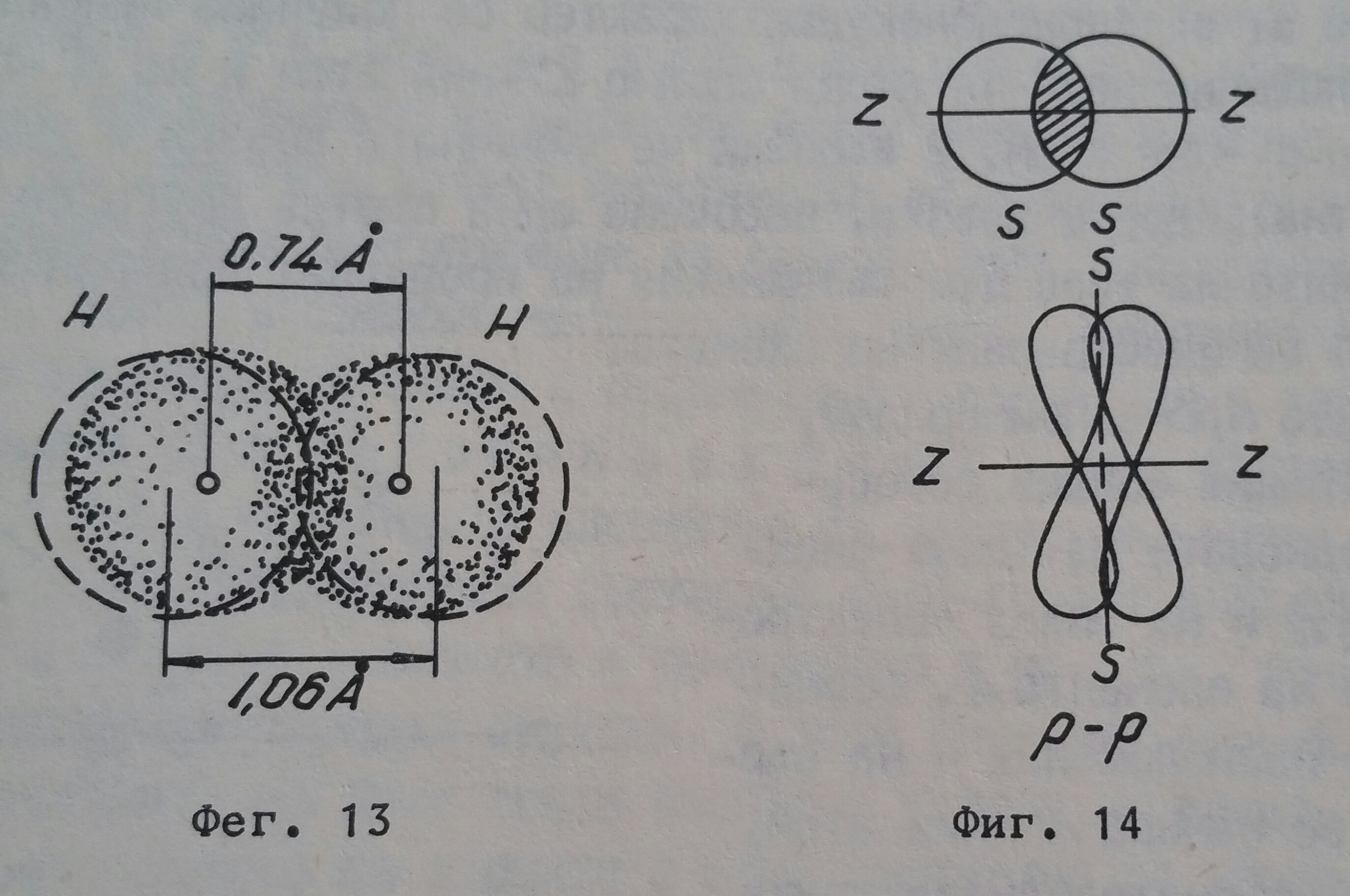
Електронният облак в s-състояние се намира на 0,53 Å от атомното ядро и би трябвало при формирането на водородната молекула разстоянието между ядрата на двата атома да бъде равно на 1,06 Å. Фактически то е 0,74 Å, което говори, че електронните облаци на двата атома частично се припокриват с отделяне на енергия. Това е посочено на фигура 13. Молекулният електронен облак се разполага симетрично между ядрата на двата атома, когато връзката е върху основата s-s или пък p-p електрони. Той е по-плътен отколкото при отделните атоми. При паралелни спинове очевидно молекулен облак не съществува или неговата плътност е равна на нула, тоест химичен процес не е протекъл.
В зависимост върху каква основа се изгражда връзката - дали е при участието на s-s, p-p, p-d, s-p и прочие електрони, припокриването на електронните облаци бива различно Но са възможни два гранични случая на формиране на ковалентната химична връзка, означвани като σ и π връзки. Сигма (σ) - връзката се получава когато припокриването на електронните облаци става по осовата линия z-z, свързваща двете атомни ядра, а пи (π)-връзката, когато припокриването е перпендикулярно на осовата линия (z-z), както това е дадено на фигура 14.
По правило припокриването на σ-връзката е по-пълно, по-здраво и съпроводено с отделяне на по-голямо количество енергия. Освен това се вижда, че при s-p връзката (молекулите на HCl, HF и други) молекулният електронен облак означаван с (:) е изнесен повече към водородния атом, а не към хлорния атом, както обикновено се отбелязва. Въобще разположението на молекулния електронен облак при разнотипни атоми в молекулата при еднакви други условия зависи от формата на електронните облаци в отделните атоми.
При ковалентната връзка са характерни две особености:
- Разстоянието между ядрата на свързаните атоми е адитивно, тоест сума от радиусите (ковалентните радиуси) на двата атома.
- Тя показва известна насоченост (векторност) в пространството. При всички случаи молекулите АА (еднотипни атоми) и AB (разнотипни атоми) имат линейна форма.
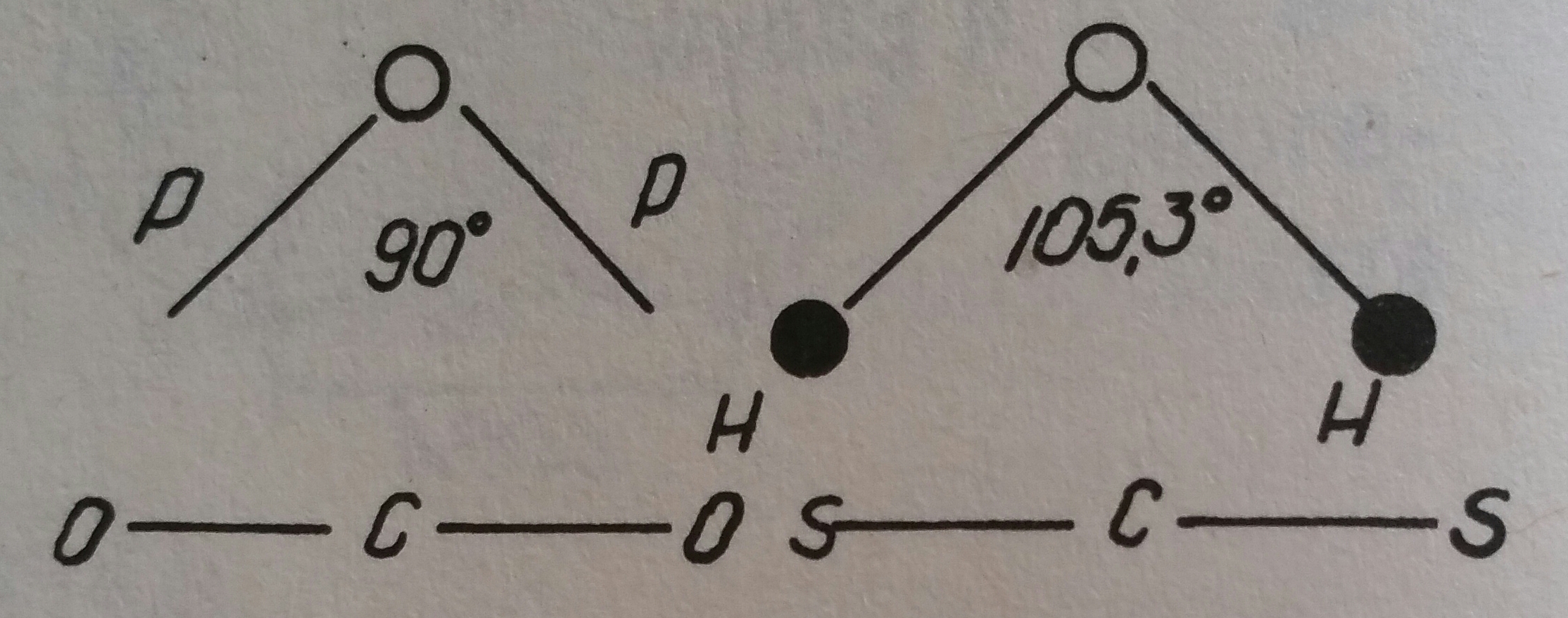
 При случаите на молекулите A2B ковалентната връзка се осъществява при участието на два p-електрона от атома B и s-електроните на атома А. Например при H2O молекулата се изгражда от двата p-електрона на O-ния атом и s-електроните на двата H-ни атома. При кислородния атом двата p-електрона (електронни облаци), като отрицателно заредени, се отблъскват в пространството под ъгъл 90 градуса. Като се свържат с s-електроните на H-те атоми, би трябвало този валентен ъгъл да се запази, но всъщност той се увеличава до 105,3 градуса под влияние на взаимното отблъскване на s-електроните. Този стеричен електростатичен ефект се нарича разширение на валентния ъгъл. По такъв начин разположението на H-те атоми спрямо O-ния атом не е линейно, а е под известен ъгъл. Това определя полярността на водната молекула с диполен момент от 1,84 D. Не е такъв случаят при молекулите на CO2, CS2 и други, където по причини от вътрешномолекулен характер се получава линейно, симетрично разположение на O-te атоми спрямо C-ният атом и на S-te атоми също спрямо C-ния атом. И въпреки че химичната връзка и тук е полярна (ковалентна), двете връзки, насочени една против друга се унищожават и молекулите на тези две съединения не проявяват полярен характер. Двата случая са илюстрирани на схемата вляво.
При случаите на молекулите A2B ковалентната връзка се осъществява при участието на два p-електрона от атома B и s-електроните на атома А. Например при H2O молекулата се изгражда от двата p-електрона на O-ния атом и s-електроните на двата H-ни атома. При кислородния атом двата p-електрона (електронни облаци), като отрицателно заредени, се отблъскват в пространството под ъгъл 90 градуса. Като се свържат с s-електроните на H-те атоми, би трябвало този валентен ъгъл да се запази, но всъщност той се увеличава до 105,3 градуса под влияние на взаимното отблъскване на s-електроните. Този стеричен електростатичен ефект се нарича разширение на валентния ъгъл. По такъв начин разположението на H-те атоми спрямо O-ния атом не е линейно, а е под известен ъгъл. Това определя полярността на водната молекула с диполен момент от 1,84 D. Не е такъв случаят при молекулите на CO2, CS2 и други, където по причини от вътрешномолекулен характер се получава линейно, симетрично разположение на O-te атоми спрямо C-ният атом и на S-te атоми също спрямо C-ния атом. И въпреки че химичната връзка и тук е полярна (ковалентна), двете връзки, насочени една против друга се унищожават и молекулите на тези две съединения не проявяват полярен характер. Двата случая са илюстрирани на схемата вляво.
При молекулата A3B например NH3 молекулните електронни облаци се осъществяват върху основата на три p-електрона от елемента B и на три s-електрона от трите атома на елемента А. Формира се пирамидално разположение - на върха на пирамидата се намира N-ния атом, а по ъглите на триъгълната основа трите H-атома.
В невъзбудено състояние C-ният атом има електронна формула 1s22s22p2, а във възбудено 1s22s12p3. При формирането на молекулата на метана CH4 се изграждат три s-p и една s-s връзка. Последната се отличава от трите връзки. Но всъщност CH4 и четирите връзки са напълно равностойни. Това противоречие се обяснява с преминаването на електроните от s и p-подравнищата в някакво средно подравнище q. Това средно подравнище, най-изгодно равнище, се обозначава като хибридно подравнище. В него четирите електрона са напълно равностойни и връзките, формирани с тях, са съвършено равноценни. Те са насочени от центъра на един тетраедър C-ия атом) към неговите четири върха (H-те атоми). Наблюдавани са немалко случаи на подобна xибридизация.
Под влияние на външно електрично поле в ковалентната връзка се извършва процес на поляризация, който може да я превърне понякога в йонна връзка. Онези полярни връзки, които лесно преминават в йонни, се означават като йоногенни връзки. Такъв е случаят с полярните молекули на халогеноводородите, които под влиянието на електричното поле, създавано от водните молекули, се дисоциират на йони. В случая се говори за междумолекулна поляризация.
Когато разликата в свойствата на двата елемента е много голяма, тоест техните атоми са много различни по отношение на електроннофилността, тогава електронната двойка силно се измества в посока на по-електронофилния атом, просто попада изключително в сферата на действие на този атом. В случая се говори за йонна връзка, наричана още електровалентна или хетерополярна, а молекулата - йонна или хетерополярна молекула. Такъв е случаят с образуването на молекули между неметал и метал - K и F, Na и Cl, и прочие. При тази връзка практически се обособяват йони. Йонната молекула съществува благодарение на силното електростатично привличане. Атомът, който е обсебил електронната двойка, се явява отрицателно зареден, а другият, от който е отдалечена - положително зареден. Първият се нарича електронноакцептор, а вторият - електроннодонор. Колкото елементът се намира по-наляво и по-долу в периодичната система, толкова съответно е по-голяма електроннодонорната функция и обратно - колкото по-надясно и по-горе, толкова е по-голяма електронноакцепторната функция. В този последен случай на йонна връзка представите на Люис почти съвпадат с тези на Косел.
При превръщането на атомите в йони съответно се променят радиусите на атомите. Атомът електроннодонор намалява радиуса, а атомът електронноакцептор го увеличава. Тази промяна е за очакване; причините са очевидни.
Характерът на химичната връзка дава съществен отпечтък върху свойствата на веществата. Съединенията, изградени върху основата на йонната връзка, са твърди, температурите на стапяне и кипене са високи, а тези, образувани от неполярна молекула, са обикновено газове или течности с ниски температури на стапяне и кипене. Това се дължи на слабото междумолекулно взаимодействие. Иначе, когато се касае за разкъсването на ковалентната връзка, необходимо е изразходването на значително количество енергия. За разкъсването на неполярната връзка при водородната молекула е необходимо да се изразходва 105kcal за грам-мол водород, при азота - 170,2 kcal за грам-мол азот и прочие. Една картина за изменението на температурите на стапяне и кипене в зависимост от природата на химичната връзка дава следната поредица от съединения:
| Температура на стапяне в 0C | Температура на кипене в 0C |
| Неполярна F2: -2180 | Неполярна F2: -1870 |
| Полярна HF: -830 | Полярна HF: 19.50 |
| Йонна NaF: 9950 | Йонна NaF: 17020 |
Както се вижда, меродавен отпечатък върху стойността на тези две температури дава йонната връзка. При по-сложните случаи на съединения, където са налице двете или трите основни химични връзки, върху температурата на стапяне същетвен отпечатък дава пак йонната връзка. При Na2SO4, който може да се разглежда като Na2O.SO3, връзката между Na и O е йонна, а между S и O е полярна. SO3 се стапя при 16,80C, а Na2O при 9200C. Na2SO4 като съединение се стапя при 8850C, а не при средната аритметична температура 4680C, тоест при температура, която е далеч по-близка до температурата на стапяне на натриевия окис.
За характеризирането на здравината на химичната връзка в енергитично отношение е въведено понятието енергия на връзката - количество енергия, което е необходимо да се изразхода за разкъсване на връзката, сметнато за грам-молно количество. Енергията на връзката зависи от кратността на връзката (дали е единична, двойна или тройна). Например в поредицата C-C, C=C и C≡C енергията на връзката се изменя съответно 84,3 kcal, 146,4 kcal и 193,3 kcal. Очевидно, когато се изгражда химичната връзка, тогава се отделя енергия.
Неполярната, полярната и йонната връзка са основните видове химични връзки. Наред с тях съществува и така наречената водородна връзка. Оказало се, че когато водородният атом е свързан с атома на F и O и други силно електроотрицателни елементи иам способността да се свързва с втори атом - на O и F. Молекулите на HF в течност чрез водородната връзка формират веригата H-F... H-F... H-F... H-F. Такава верига се образува и в течната вода дори и в реда:
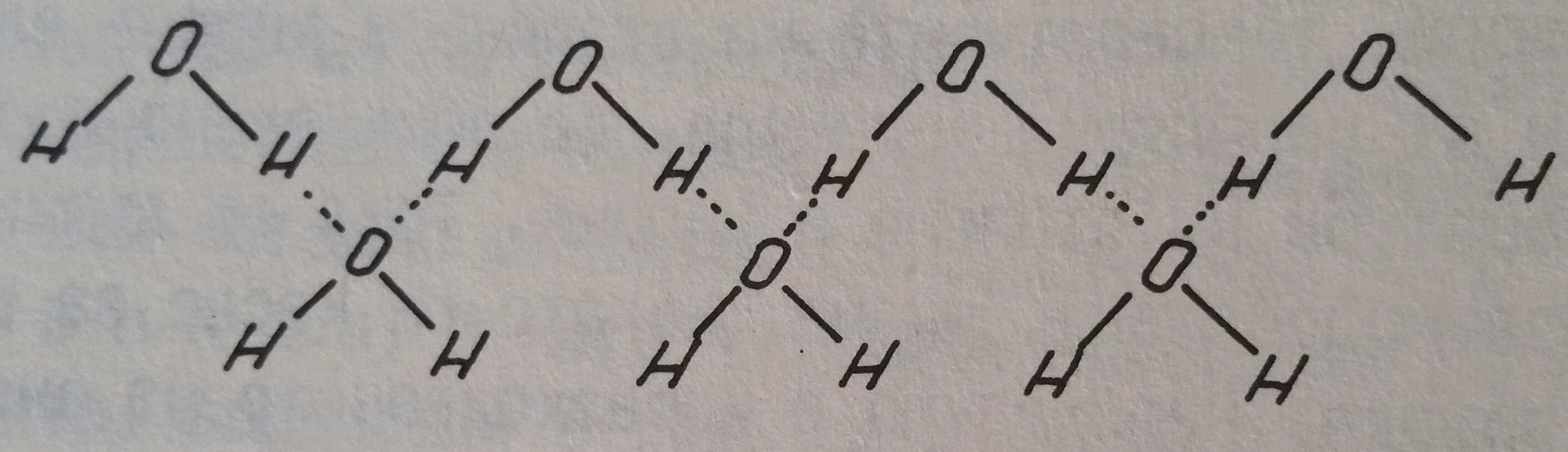
Както се вижда, върху основата на тази връзка протича процес на асоциация на молекулите на тези вещества. Причината за възникването на водородната връзка в общи черти се крие в това, че водородният йон за разлика от другите йони представлява само ядро (протон). Като иам много малки размери, може да се приближава съвсем близко до други атоми (йони) и да се свързва с тях, дори да се вмъква в електронните им обвивки. Водородната връзка, като химичната връзка, е много слаба и тя по-скоро се приближава до силите, които действат между молекулите. Въпреки това тя играе съществена роля при мокренето на твърди вещества, набъбването на белтъците, абсорбцията и прочие.