Графична адсорбционна изотерма (на снимката)
Под адсорбция се разбира самоволната промяна на концентрацията на единия от компонентите на една хетерогенна система върху граничната повърхност, разделяща двете фази. Вижда се впрочем, че адсорбцията е гранично повърхностен процес и следва да се отличава от адсорбцията, при която поглъщането на компонента става в целия обем (маса) на веществото, което абсорбира. Очевидно абсорбцията е обемен процес. Например амонякът се абсорбира от водата, но се адсорбира от активния въглен.
Веществото, което адсорбира, се означава като адсорбент, веществото, което адсорбира, тоест концентрира на повърхността - адсорбтив, а комплексът (повърхностен) от адсорбента и адсортива - адсорбат. Последният очевидно няма състава на адсорбента и адсорбтива. когато двата процеса не могат да се различат, тогава се говори за сорбция и съответно имаме обозначенията сорбтив, сорбент и сорбат. Обратният процес на адсорбцията се нарича десорбция. Докато адсорбцията протича с голяма скорост, десорбцията протича с малка. При това десорбцията никога не протича докрай, което говори, че адсорбатът като система е извънредно стабилна.
Основната причина на адсорбцията е "ненаситеността" на повърхността на адсорбента. Докато в неговата вътрешност градивните частички (атоми или йони) от всички страни в пространството са уравновесени, тези, които се намират на повърхността "отдолу" изпитват взаимодействие с подобните на тях частички, а отгоре това взаимодействие не е компенсирано - на повърхността на адсорбента съществува ненаситено силово поле, характеризиращо се с известен запас свободна енергия, наричана повърхностна, и то определя абсорбцията като явление, едно междумолекулно взаимодействие върху основата на кулоновите сили или вандерваалсовите сили между повърхностно лежащите частички на адсорбента и частичките на газа адсорбтив, който се намира в допир с адсорбента.
Адсорбцията не протича равномерно по цялата повърхност на твърдия адсорбент, а на определени негови места, наричани активни центрове. В общи черти те представляват "нарушения" на повърхността, които, отличаващи се със значително по-голямата си "ненаситеност", върху тях протича абсорбционният процес.
Изучаванията на дебелината на адсорбционния слой са показали, че в едни случаи е едномолекулен, а в други полимолекулен. Очевидно тя зависи от условията, при които се извършва адсорбцията и от природата на адсорбента и адсорбтива.
В термохимично отношение адсорбцията е екзотермичен процес, тоест придружен с отделяне на топлица, а десорбцията е ендотермичен процес. При повишение на температурата адсорбцията намалява, а десорбцията се увеличава (по т.нар. принцип на Льо Шателие-Браун). Например 1 грам активен въглен при около 120 градуса по Целзий адсорбира приблизително 10 пъти по-малко водород, отколкото при 0 градуса по Целзий.
Тъй като адсорбцията е гранично повърхностен процес, следва при еднакви други условия количеството адсорбирано вещество да зависи от дисперзитета на адсорбента. По тези причини силно порестите и прахообразните адсорбенти имат голяма адсорбционна способност. Представа за промяната на сумарната повърхност при стриването на една твърдна система при предпоставката, че частичките са кубчета, дава таблицата по-долу:
| Дължина на ръба (в см) | Брой на кубчетата (в см3) | Сумарна повърхност |
| 1 | 1 | 6 см2 |
| 1*10-3 | 1*109 | 6 000 см2 |
| 1*10-5 | 1*1015 | 60 м2 |
| 1*10-6 | 1*1018 | 600 м2 |
| 1*10-8 | 1*1024 | 60 000 м2 |
При газови адсорбтиви и твърди адсорбенти, при еднакви други условия, степента на адсорбцията зависи от критичната температура на газа адсорбтив. Колкото тя е по-висока, с известно приближение, колкото температурата на втечнявате е по-висока, съответно толкова адсорбируемостта на газа е по-голяма. При условия 760 мм налягане, 150C температура и адсорбент активен въглен водород с критична температура -2400C (температура на втечняване -2520C) се адсорбира 5см3/г, докато серният двуокис с критична температура +1570C (с температура на втечняване 100C) се адсорбира 380 см3/г.
Ако даден разтвор съдържа молекули с различен диполен момент, естествено те всички ще дифундират към граничната повърхност, например течност - течност и прочие. Обратната дифузия от граничната повърхност към обема на разтвора ще бъде значително затруднена за по-малко полярните молекули, тъй като полярните молекули ги "изтласкват" към тази повърхност. По такъв начин на фазовата граница (граничната повърхност) се натрупват по-слабо полярните молекули с по-малък диполен момент, при което повърхностното напрежение на разтворителя съответно се намалява. Такива вещества се адсорбират положително и се наричат повърхностно (капилярно) активни вещества. Това са дифилни вещества, тоест такива, на които единият край на молекулата е хидрофобен, а другият хидрофилен. Тук са алкохолите, алдехидите, кетоните, белтъците и прочие. На алкохола RCH2OH или карбоновата киселина RCH2COOH частта от молекулата RCH2 има неполярен характер, хидрофобна част, докато -OH (-COOH) е полярната част и притежава хидрофилни отнасяния. Сапуните също са повърхностни активни вещества и миещото им действие се дължи главно на повърхностно активните им свойства. Замърсяванията (сажди, прах и други), които са най-често с хидрофобен характер, не могат да се измият само с вода. Когато в последната има сапун, молекулите му се ориентират към частиците на замърсяването така, че хидрофобният край е насочен към частиците, а хидрофилният - към водата. По този начин става известна "хидрофилизация" на частичките и те се отделят чрез водата от замърсената повърхност. Понастоящем са "развити" перилни препарати, синтетични вещества, на които измивателното действие се дължи на повърхностно активните им свойства. Това са така наречените детергенти. Онези вещества, които не се концентрират на граничната повърхност, а остават в обема на разтвора, не променят практически повърхностното напрежение на разтворителя (адсорбцията им е отрицателна) се означават като повърхностно (капилярно) неактивни. Това са неорганичните киселини, неорганичните соли и прочие.
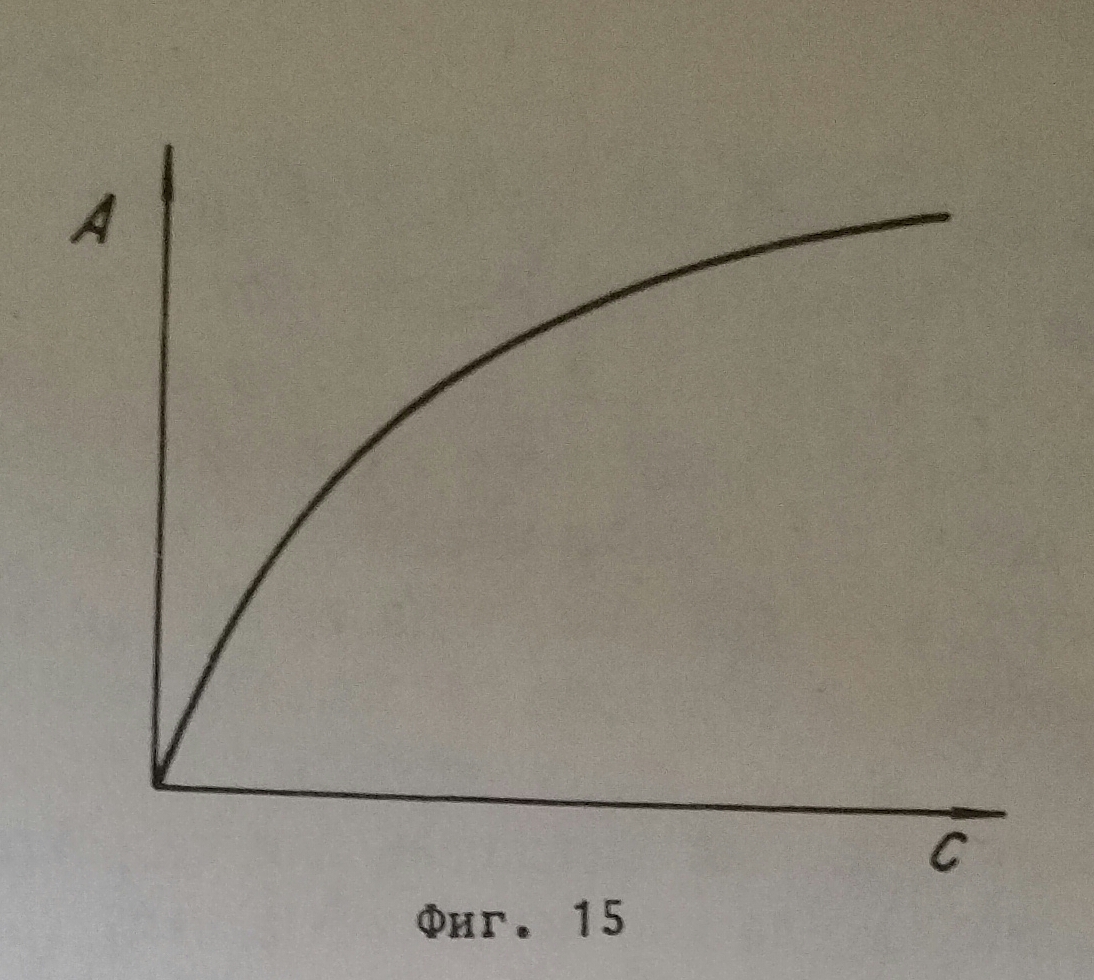
Характерният белег на адсорбцията е динамичното равновесие, при което за дадения вид условия броят на молекулите, които напускат повърхността, е равен на броя на молекулите, които постъпват на повърхността, сметнато за единица време и единица повърхност. При него скоростта на адсорбцията е равна на скоростта на десорбцията. Адсорбционното равновесие при неизменна повърхност зависи освен от температурата, както се отчете по-горе, но още и от концентрацията на адсорбиращото се вещество. Зависимостта между адсорбираното количество А и концентрацията на адсорбиращото се вещество C при адсорбционното равновесие при постоянна температура, така наречената адсорбционна изотерма, се дава относително просто с уравнението на Фройндлих.
А=kC1/n, сметнато за 1 грам адсорбент. K и n представляват постоянни величини, които се определят по експериментален път. Графично адсорбционната изотерма е дадена на фигура 15. От нея се вижда, че при малки стойности на C адсорбцията е повече застъпена (почти право пропорционално), отколкото при по-големи стойности. Отива се в крайна сметка към една постоянна стойност, което е за очакване, тъй като повърхността се насища. Уравненоето на Фройндлих не е всеобхватно. Наред с него са дадени и други уравнение - на Лангмюир, на Реми и Кроон и други, които са по-обхватни, но и те напълно не изчепват споменатата зависимост.

Съществуват различни видове абсорбции:
- Капилярна кондензация. Тя протича при адсорбцията на пари (газове) с относително висока температура на втечняване. В порите на адсорбента се получава течна фаза. Например адсорбцията на водни пари върху силикагела и други.
- Хемосорбция. При нея между адсорбента и адсорбтива протича химичен процес. Такъв е случаят при адсорбцията на кислорода върху металите Al, Zn, Mg и прочие, при които се получават съответните окиси на CO2 върху NaOH, при което се получава Na2CO3 и прочие. Тук адсорбентът се означава като хемосорбент.
При адсорбцията на електролити из водни разтвори се различават следните видове адсорбция:
- Еквивалентна адсорбция. Добре адсорбиращите се йони се адсорбират заедно с противоположно заредените йони, които иначе не се адсорбират добре. И тъй като еквивалентността на йоните в адсорбтива се запазва, като че ли се адсорбират молекули, понякога тази адсорбция се нарича молекулна.
- Специфична адсорбция. При нея адсорбентът адсорбира специфично единия йон, а другият остава в разтвора. При нея еквивалентността не е запазена и поради това между адсорбентът и разтвора се разлизира известна потенциална разлика, различно електрично заредени. Адсорбираните йони се назовават потенциалоопределящи.
Кои йони ще се адсорбират върху йонно изградения твърд адсорбент AgI, BaSO4 и прочие, регламентира правилото на Панет-Фаянс: на граничната повърхност на йоннопостроения адсорбент се адсорбират онези йони из разтвора, които образуват с противоположно заредените йони на адсорбента малкоразтворимо или слабоелектролитно дисоцируемо съединение. AgI из разтвора на KI (йоните K+ и I-) адсорбира I-, тъй като с Ag+ от йонноизградения адсорбент AgI образува малкоразтворимото съединение AgI. Из разтвора на AgNO3 (Ag+ и NO3-) се адсорбират пък Ag+, тъй като с /- от адсорбента образува също малкоразтворимото съединение AgI.
- Обемна адсорбция. При тази адсорбция намиращите се на повърхността на адсорбента даден вид йони при съответни условия в допир с подходящ електролит става замяната на адсорбираните йони с други йони пак със същия знак, при което електронеутралността на адсорбента и разтвора се запазва. Например това е случаят на замяна на SO42- с Cl- върху адсорбент Al(OH)3 или Fe(OH)3. Когато в адсорбцията участват водородни или хидроксилни йони, разтворът може да придобие кисела или алкална реакция. Говори се в случая за така наречената хидролитна адсорбция.
- Вътрешна адсорбция. Тя е по-сложна по вид адсорбция, при която участва както външната, така и вътрешните повърхности на адсорбента, разгледан като дисперсно построен реален кристал.
Адсорбцията е особено важна за практиката, биологията, медицината и прочие. Върху нейна основа е построен при участието на активния въглен противогазът, а под формата на така наречения карбоанималис (животински въглен) той се използва за вътрешно лекуване на някои чревни заболявания. Силно охладен, намира приложение при съответно развити вакуумни апаратури за получаването на висок вакуум, както и на много ниски температури. Редица манипулации в кожарската, захарната и масларската промишленост - боядисването на тъкани и омекотяването на твърди води са тясно свързани с адсорбционни процеси. Посредством адсорбцията, пак върху основата на активния въглен, могат да се разделят газовете помежду им, когато са в смес - разделянето на благородните газове един от друг. Върху основата на специфичната адсорбция е развит така нареченият хроматографски метод, широко използван в химичния анализ и в промишлеността. Адсорбцията е от съществено значение за онечистването (чистотата) на твърдите вещества. Най-сетне адсорбцията е важна и в биологичноотношение. Живата материя може специфично да адсорбира едни или други вещества и според природата им се получават смущения или подобрения в организма. Освен това адсорбицята играе немалка роля и при хетерогенната катализа при твърд катализатор, почвените процеси, усвояването на храните и прочие.