Ако разгледаме образуването на амониевите халогениди от NH3 и NX (X - халогенен елемент Cl, Br и други), се вижда, че то се дължи в общи черти на привличането на H+ от амонячната електронеутрална молекула, като се формира амониевият йон NH4+, въпреки че H+ се привлича и от съответния халогенен елемент. Тук не се извършва прескачане на електрони или образуване на електронна двойка. Онези съединения, които се образуват при взаимодействието на прости (валентно наситени) молекули с други молекули, атоми или йони, без да се изгражда електронна двойка, се означават като комплексни съединения. Например NH3+ H+Cl- = [NH4]+Cl- или AgCl + 2NH3 = [Ag(NH3)2]+Cl- и прочие.
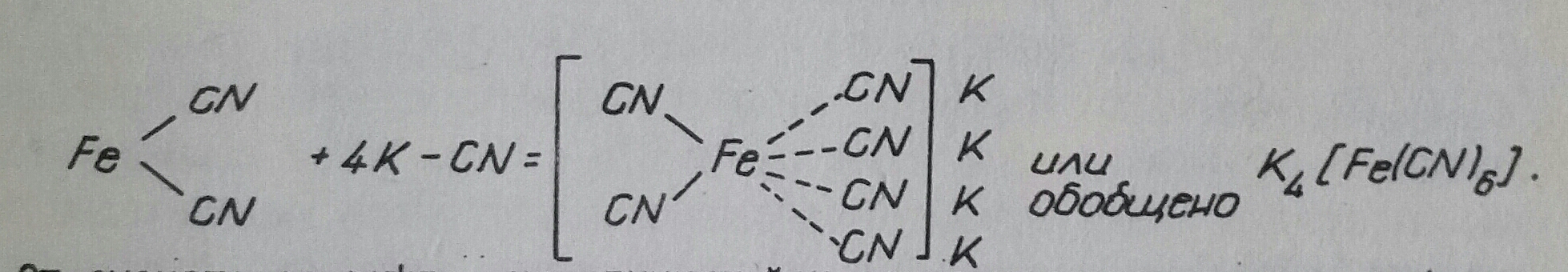
Известни още от миналото столетие, Берцелиус ги нарече "молекулни съединения" или "съединения от втори порядък" за разлика от "простите (атомни) съединения" или "съединения от първи порядък". Те бяха обект на изследване от Чугаев, Пфайфер, Ханч, Черняев и други, но особено много допринесе за тях А. Вернер (1893), който ги назова "съединения от висш порядък". Чрез възвестената от него "координационна теория" той даде представа за тяхното формиране, като прие, че наред с "главната валентност", която е причина за образуването на простите атомни съединения и означавана в структурните формули с чертички, съществува и "вторична валентност" основната причина за изграждането на комплексните съединения, обозначавана с пунктир. Например образуването на калиевия фероцианид от фероцианид и калиев цианид:

От схемата се вижда, че единият йон заема централно място и около него се разполагат съответен брой противоположно заредени йони, а може и молекули. Този йон се нарича комплексообразувател, а разположените около него йони или молекули - аденди или лиганди. Адендите с комплексообразувателя формират така наречената вътрешна координационна сфера. Тя се загражда в средни скоби. Броят аденди е координационното число. То зависи от размерите на адендите и комплексообразувателя. Онези йони, които са извън вътрешната сфера, формират външната координационна сфера и се нарича йоногенно свързани. В горния пример Fe2+ е комплексообразувателят, 6-те на брой CN- са адендите, а К+ са йоногенно свързани с вътрешната сфера, заградена в средни скоби. Често срещани комплексообразуватели са Fe2+, Hg2+, Ag+, N3- и прочие и аденди CN-, I-, F-, H-, Cl- и много други. Най-често срещаните координационни числа са 2, 4, 6 и 8. Рядко срещани са 3 и 12. Не във всички лучаи е застъпена максималната стойност на координационното число. В първия случай се говори за координационно наситено, а във втория - за координационно ненаситено комплексно съединение.
Способността към комплексообразуване е по-пълно изразена в химичните елементи от вторичните подгрупи на периодичната система, тоест тези, които притежават подвалентен електронен слой от 8 до 18 електрона.
Често се говори за координационна емкост (капацитет) на адендите. Тя представлява броя места, които би могъл даден аденд да заеме във вътрешната сфера. За повечето аденди е 1, по-рядко - 2, а още по-малко - 3 или 4. Например при Cr3+ с кородинационно число 6 са възможни комплексни съединения при капацитет 1 и 2 - K3(Cr(CN)6] и K3[Cr(C2O4)5]. Очевидно този показател е тясно свързан с координационното число на комплексообразувателя. Съществуват различни видове комплексни съединения според природата на адендите, броя аденди и прочие.
Кристалохидрати и кислородосъдържащи киселини
В съответствие с казаното относно формирането на комплексните съединения следва да се приеме, че кристалохидратите и кислородосъдържащите киселини и техните соли представляват комплексни съединения. Кристалохидратите FeCl3.6H2O, CoCl2.6H2O, CuSO4.5H2O и други могат да се напишат [Fe(H2O)6]Cl3.[Co(H2O)6]Cl2 хидратите се наричат аквокомплекси. Те се формират тогава, когато при съществуващите условия връзката между положително заредения комплексообразувател и полярните водни молекули, съответно ориентирани около него, е толкова здрава, че при кристализацията те не го напускат и се включват във вътрешната сфера на аквокомплекса. Във връзка с изложеното следва и кислородсъдържащите киселини и техните соли да се разглеждат като комплексни съединения. Например на H2SO4 и H3PO4 се дават следните комплексни формули:

Комплексообразувателят е S и P, адендите са O-те атоми, координационното число е 4. Йоногенно са свързани H-те йони, а при солите съответни метални йони. В частност се изграждат така наречени ацидокомплекси.
Амиакати (амониакати)
Тук спадат комплексните съединения с аденди електронеутралните амонячни молекули. Например [Ag(NH3)2]Cl; [Ca(NH3)8]Cl2; [Cr(NH3)6]Cl3 и други. Върху основата на комплексообразувателя някои от тях носят по-специални названия - хромиаки Cr3+, кобалтиаки Co2+, платики Pt+.
Полихалогениди
Това са случаите, при които към халогенния елемент на простия халогенид се притъкмяват нови халогенни елементи - K[Cl3], Rb[Br]3, K[ICl3], Na[ICl3] и прочие. Аналогични на тях са полисулфидите, полиселенидите и техните аналози.
Бикомплексни съединения
Те се състоят от комплексен катион и комплексен анион - [Co(NH3)6][Cr(CN)6] и други. Съществуват и други разновидности комплексни съединения - циклични, аминати, полиядрени и прочие.
При комплексните съединения се наблюдават различни видове изомерия. Това е явлението, при което вещества с един и същ качествен и количествен състав и молекулна маса, притежават различни свойства, дължащо се на разликата в строежа на молекулите на изомерните форми.
Хидратна изомерия
В общия случай се нарича солватна. Дължи се на различното разпределение и брой на водните или пък други молекули между вътрешната и външната координационна сфера. Например при хрома. Познати са [Cr(H2O)6]Cl3 - виолетово оцветен; [Cr(H2O)5Cl]Cl2H2O - светлозелен; [Cr(H2O)4Cl2]Cl.2H2O - тъмнозелен цвят. Освен по цвета количеството хлорни йони, утаими с AgNO3, е различно. При първото съединение са утаими трите, при второто двата, а при третото - единият. Утаими са само йоногенно свързаните хлорни йони.
Тук му е мястото да се засегне въпросът за заряда на комплексния йон. В обощение зарядът на комплексния йон се определя от алгебричната сума от зарядите на комплексообразувателя и зарядите на адендите йони; адендите без заряд, тоест електронеутралните молекули, са без значение. Ако алгебричната сума има положителен знак, комплексният йон представлява катион и обратно - комплексен анион. При нулева стойност налице е комплексен неелектролит. Например: (ε - заряд на комплекса).
- [Cr(H2O)6= E=(+3)+(0,6)=+3 тривалентен комплексен катион
- [Cr(H2O)4Cl2] E=(+3)+(0,4)+(-1,2)=+1 едновалентен комплексен катион
- [Cr(H2O)3Cl3] E=(+3)+(0,3)+(-1,3)=0 електронеутрален комплекс (неелектролит)
Йоногенно свързаните йони не са дадени в примерите.
Йонизационна изомерия
Това са комплексни съединения с еднакъв състав, които във воден разтвор се дисоциират на различни йони поради размяна на частици между вътрешната и външната сфера, съединението Co(NH3)5Br(SO4) е известен в две изомерни форми - първата [Co(NH3)5Br]SO4 и втората [Co(NH3)5SO4]Br.
Координационна изомерия
Това са комплексни съединения,, в които участват два комплексообразувателя при разнотипни аденди, които (аденди) различно се разпределят между двата комплексообразувателя. Например [Cu(NH3)4].[Pt+Cl4] - виолетово оцветен и [Pt(NH3)4].[CuCl4] - зелено оцветен. Наред с тези изомерии съществуват още геометрична, оптична и прочие.
Устойчивост на комплексния йон. Двойни соли
Различните комплексни съединения имат различна устойчивост за обикновени условия. Устойчиви са например [Fe(CN)6]4-, [Cu(CN)2]-, [Cu(NH3)4]2+ и други, а други като [PbI]+, [Ag(NO3)2]- не са така стабилни. За характеризиране на комплексността или устойчивостта на комплексния йон е въведена така нареената стабилитетна константа и реципрочната й стойност - константа на неустойчивост. Например при комплексното съединение K4CFe(CN)6] са възможни две степени на електролитна дисоциация - K4[Fe(CN)6] са възможни две степени на електролитна дисоциация - K4[Fe(CN)6] ← → 4K+ + [FeCN6]4 - и [Fe(CN)6]4- ← → Fe2+ + 6CN-. Ако отбележим за втората степен на електролитна дисоциация стабилитетнта константа с Kc, тя възлиза на:
Kc=([Fe2+][CN-]6) / [Fe(CN)6]4- = 1*10-37 , а константата на неустойчивост, отбелязана с K-H-
KH=([Fe(CN)6]4-) / ([Fe2+][CN-]6)=1*10-37
Колкото по-малка е стойността на стабилитетната константа (отношението между произведението от грамйонните концентрации на крайните продукти върху грам-йонната концентрация на изходния комплексен йон) или по-голяма стойността на константата на неустойчивост (обратното отношение при стабилитетната константа), толкова съответно е по-голяма устойчивостта (стабилността) на комплексния йон и обратно.
Онези комплексни соли, които имат много малка стойност на стабилитетната константа като например K2[CuCl4], K[MgCl3] и други, което говори за много малка неустойчивост на комплексния йон, се обозначават като двойни соли и техните формули не се пишат като двойни соли и техните формули не се пишат като комплексни съединения, а както следва: 2KCl.MgCl2, KCl.MgCl2 и прочие. По този начин се дават формулите на стипците - K2SO4.Al2(SO4)3.24H2O, на шьонитите - K2SO4.MgSO4.6H2O и прочие. Така че при двойните соли практичеки липсват комплексни йони, а са налице само прости йони. Не е застъпена електролитната дисоциация на K2[CuCl4]=2K+ + [CuCl4]2 с комплексен йон, а е застъпена 2K+ + Cu2+ + 4Cl- с прости йони. При типичните комплексни съединения комплексният йон се характеризира с определени аналитично химични реакции. При K4[Fe(CN)6] анионът [Fe(CN)6]4- с Fe3+ дава синя утайка, която не е присъща за Fe2+ или за CN-. CN- не е отровна, както например KCN, тъй като концентрацията на отровния CN - йон е далеч по-малка от онази, при която организмът бива умъртвяван. Между тези два гранични случаи - комплексни съединения и двойни соли, има преходи, като в някои случаи не можем да отчетем наприемр солта комплексна сол ли е или е двойна сол. Такъв е случаят с Na3[Co(NO2)6] (натриев кобалтинитрит). Последният при своята електролитна дисоциация, двупосочна Na3[Co(NO2)6] ← → 3Na+[Co(NO2)6]3- и 3Na+ + Co3+ + 6NO-2 дава както комплексни йони с характерна аналитично химична реакция, така и прости йони в доказуема концентрация.
От казаното следва да заключим, че когато се говори за типични комплексни съединения и двойни соли, това не трябва да се разбира в абсолютния смисъл на думата.
В началото на раздела "Комплексни съединения" бе дадена първата представа (на Вернер) за формирането на комплексните съединения, а така също и основата на електростатичната теория - при изграждането на тези съединения не става прескачане на електрони (по Косел) или пък формирането на електронни двойки (по Люис), както е при простите обикновени съединения. Чрез нея можаха да се обяснят редица частни случаи при комплексообразуването. Като се взе предвид поляризацията между аденди и комплексообразувател можа да се разясни защо амиакатите са по-стабилни от аквакомплексите, защо слабите киселини, влезли в състава на комплексно съединение, се явяват силни киселини и прочие. Връзката, която се формира в комплексните съединения, се назова координационна връзка, наричана понякога йон-диполна връзка.
Другият подход за обясняване на изграждането на комплексните съединения е даден от Сиджвик (1927). В основата му стои приемането, че атоми, които имат свободни електронни двойки в рамките на дадена молекула, проявяват в известно отношение стремежа да ги свързват с други молекули или йони както и това, че атоми, които нямат завършен най-външен електронен слой, имат тенденцията да попълват последния за сметка на чужди електронни двойки. Атомите от първия тип се наричат донори, а от втория - акцептори. Възникналата връзка се означи като донорно-акцепторна теория. Всъщност тази връзка се явява координационна. При образуването на комплексния йон [NH]4+ азотният атом се явява донор, а водородният отрицателен катион като акцептор. Тази теория се оказа по-обхватна, но нито тя, нито "електростатичната" можаха да изчерпят всички разнообразни случаи на комплексообразуване. По-нататъшно развитие на двете основни представи за комплексообразуването се явява методът на валентните връзки, който приема, че всеки аденд отдава електронни двойки за формиране на координационно-ковалентна връзка, протича процес на сливане с орбити на метала комплексообразувател, при което се получават нови орбити, наречени хибридни, теорията на електростатичното кристално поле, която приема за разлика от метода на валентните връзки, че връзката между комплексообразувателя и адендите е йонна, но в някои случаи се приема, че тя е ковалентна и теорията на молекулните орбити, която отчита както ковалентния, така и йонния характер на връзката.
Значението на комплексните съединения, обощени в така наречената химия на комплексните съединения (химия на координационните съединения) е голямо както в теоритично, така и в практическо отношение. Те са широко разпространени в природата - хемоглобинът, хлорофилът, различните ензими и прочие. Много редки елементи, които се срещат в тъканите на растенията и животните влизат в състава на сложни комплексни съединения. Тези съединения намират понастоящем широко приложение в различни области на живота. Разделянето на много от редките и благородните метали стана възможно чрез разлагането на подходящи техни комплексни съединения. Много ценни багрила - желязноцианидните и други, са комплексни съединения. За получаването на чисти метали - никел, манган, желязо и прочие, се използват съответни техни комплексни съединения. Те са от съществено значение при много случаи в галваностегията, химичния анализ, лекуването на някои болести и прочие.