Върху основата на геометричната форма на кристалите още преди стотици години се приемало, че на нея трябва да съответства известно подреждане на градивните частички в пространството (някаква пространствено решетъчна подредба). Въпреки че с нея успешно се е оперирало при редица кристалографски изчисления, дълго време експериментално не е била доказана.
Едва през 1912 г. Лауе със сътрудници, като пропуснал тънък сноп рентгенови лъчи през кристал, зад който била поставена фотографска плоча, получил първата рентгенограма за вътрешния строеж на кристала. Наричана още "лауеграма, тя представлявала централно черно петно, около което били разположени известен брой тъмни петна с различна степен на чернота и гъстота според отдалечеността им от централното черно петно (фигура 16). Централното черно петно се дължи на неразсеяни рентгенови лъчи, а петната около него - на разсеяни рентгенови лъчи по съответна закономерност от страна на градивните частици ан кристала. Резултатите на Лауе впоследствие послужили за основа на така наречения рентгеноструктурен анализ. Тъй като при метода на Лауе трябва да се работи с добре външно оформен кристал, което невинаги е възможно, развиха се и други методи за изследване на кристалната структура. Понастоящем се оперира най-вече с така наречения прахов метод на Дебай и Шерер (1916), при който се използва кристален прах, около концентрично се разполага филмова лента. Получената по този метод рентгенограма, наричана понякога дебаеграма, се състои от черно петно, около което концентрично се очертават ивици с различна тъмнота и гъстота, отдалечавайки се от централното черно петно. При аморфно твърдо вещество рентгенограмата, която се получава при метода на Лауе, е с размити тъмни петна, а при праховия метод - широко размити, преливащи се една в друга ивици (фигура 17).

Извършените изчисления въз основа на рентгенограмите дават възможност да се установи не само взаимното пространствено разположение на градивните частички, но още и да се получат определени указания за самата им природа. Понастоящем са установени четири типа основни кристални решетки-структури на твърдите системи по отношение на природата на градивните частички.
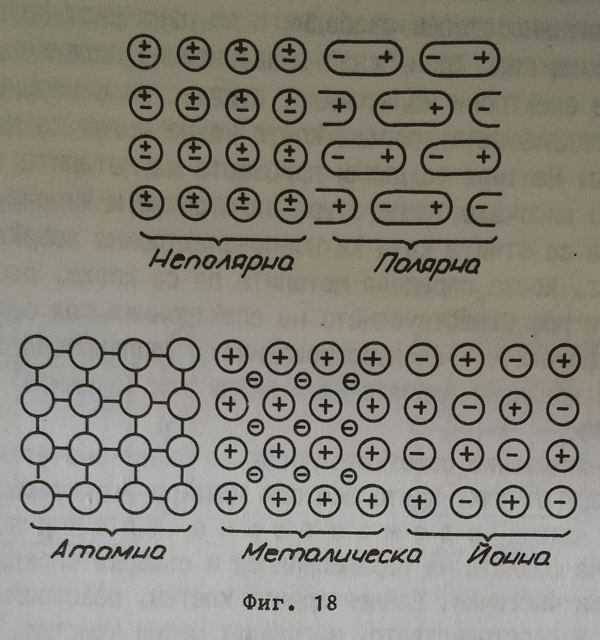
Молекулна кристална решетка
Градивните частички са полярните или неполярните молекули. Тъй като тази решетка съществува върху основата на вандерваалсовите слаби сили, веществата, които я притежават, се стапят при температури и не са много твърди. Това са органичните съединения, благородните газове NH3.CO2HCl и други В отделните молекули атомите са свързани чрез ковалентни връзки, поради което термично се разлагат при съответно високи температури.
Атомна кристална решетка
Градивни частички са атомите. Поради пълната равноценност на взаимодействие между атомите няма основание те да се обединяват един с друг в отделни молекули. Целият макрокристал представлява една огромна молекула. Връзката между атомите е ковалентна, здрава връзка и веществата с такава решетка имат висока температура на стапяне и са много твърди. Такава решетка притежава диамантът, силицият, борът, някои карбиди и прочие.
Йонна кристална решетка
Градивните частички са положителни и отрицателни йони, последователно редуващи се в пространството. Тъй като всеки йон се намира в съвършено еднакво отношение спрямо всички непосредствено заобикалящи го йони и тук не могат да се отчитат молекули и целият йонен кристал се разглежда като гигантска молекула. Действащите между йоните сили са кулоновите сили, определящи значително голямо привличане между градивните частички, поради което температурата на стапяне и твърдостта при йонните кристали е значително висока. Веществата с този тип кристална решетка са преди всичко неорганичните соли KCl, NaCl, KI, KF и много други.
Метална кристална решетка
Тази решетка е може би най-много изучаваната и въпреки това не е напълно изяснена. Във възлите й се намират положително заредени йони, между които се движат електрони, отделили се от атомите. Тези електрони взаимодействат електростатично с положителните йони, но не се закрепостяват върху тях. По тези причини те се смятат в значителна степен свободни и се означват като свободни електрони - електронен газ. Този "газ" е извънредно подвижен, подхранва се от валентните електрони на атомите, в известно отношение играе ролята на спойка между йоните, поради което те не могат да напускат ролята на спойка между йоните, поради което те не могат да напускат кристалната решетка. На това се дължи присъщата на металите твърдост, както и относително високата температура на стапяне и кипене. Понякога металната връзка се отчита като катионно-електронна връзка. Тя не проявява векторност, което определя металите да са ковки, разтеглили, да се разплескат и прочие. Съществуването на електронния газ обяснява общите отнасяния на металите - електропроводност, топлопроводност, блясък. В пари металите са предимно едноатомни и между тях (атомите) действат вандерваалсовите сили.
В структурно отношение решетките могат да бъдат значително различни. Най-малката част от тях, която все пак може да характеризира тяхната структура се нарича елементарна клетка. В най-общия случай тя има формата на паралелепипед и съдържа определен минимален брой градивни частички. Елементарните клетки, разстапяни плътно една спрямо друга в пространството и според него съществуват различни типове кристални решетки - различни типове елементарни клетки.
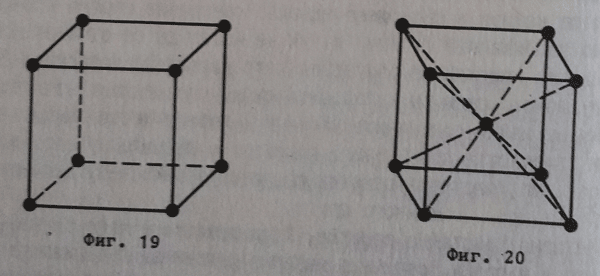
- Кубична кристална решетка (фигура 19), при която градивните частички (8 на брой) заемат върховете на куба.
- Обемно центрирана кубична кристална решетка (фигура 20), при която градивните частички (9 на брой) са разставени по върховете и в центъра на куба (по нея кристализират алкалните метали V, CsCl, Mo, Ba и други).
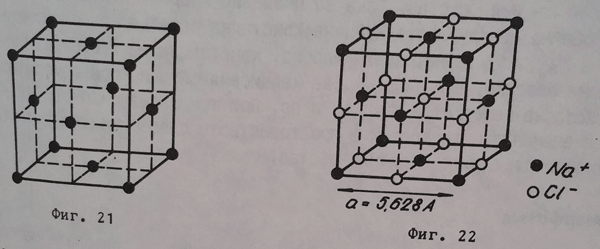
Стенно центрирана кубична кристална решетка (фигура 21), при която градивните частички (14 на брой) са разположени по върховете и в центъра на стените на куба (по нея кристализират Au, Ag, Al, Cu и други).
Тип натриев хлорид кристална решетка (фигура 22), при която градивните частички (27 на брой) са разположени по върховете, в центъра, в средата на ръбовете и в центъра на стените на куба (по нея кристализират NaCl, AgCl и други).
Освен гореизброените типове кристални решетки съществуват още хексагонална най-плътна опаковка, диамантен тип, флуоритов тип и прочие.
Съществуват и така наречената слоеста кристална решетка, присъща на MoS2 графита CdI2, PbI2 и други. Тя се състои от няколко плоскости от йони или атоми, разставени една върху друга. Между плоскостите действат обикновено вандерваалсови сили, а между градивните частички кулонови или ковалентни сили. Характерното за този тип решетка е цепителната.
Изброените типове кристални решетки представляват "опаковки", при които градивните частички, при предпоставката че са сферични, различно плътно запълват пространството. В частност при хексагоналната най-плътна опаковка и при стенно центрираната кубична кристална решетка пространството се запълва до 75%. При всяка друга е подредба - кристална решетка, запълването е по-малко. Впрочем тези две решетки са най-предпочитаните.
Броят градивни частички, разположени централно около дадена градивна частичка, се нарича координационно число. При стенно центрираната решетка е 12, при диамантения тип - 4, при обемно центрираната е 8 и прочие.
Най-малкото разстояние между центровете на две съседни градивни частички се нарича решетъчна константа. За NaCl е 2,814 Å, MgO - 2,1Å и прочие. Мярка за привличането между градивните частички в решетката за здравината на връзката се явява енергията на решетката или решетъчната енергия, която представлява енергията, която би се отделила при образуването на грам-мол кристали от градивните частички на веществото при приемането, че те биха сенамирали в състоянието на идеален газ, при температурата, при която протича кристалообразуването. Дава се обикновено в kcal/mol. За NaCl тя е 183 kcal/mol. Ясно е, че при разлагането на грам-мол кристали на NaCl до състоянието на свободни йони (такива, които не взаимодействат помежду си) ще се изразходва същото количество енергия.
Всеки тип елементарна клетка притежава характерен състав, наричан стереохимичен състав за разлика от стехиометричния състав. Така за цезиевия хлорид, който кристализира в обемно центрираната кубична кристална решетка, стереохимичният състав е Cs8Cl, за натриевия хлорид, кристализиращ в съответния тип кристална решетка, е Na14Cl13, за калциевия флуорид при флуоритов тип кристална решетка, е Ca14F8 и прочие. При тридимензиалното наслагване на елементарните клетки в пространството стереохимичният състав конвергира към стехиометричен състав.