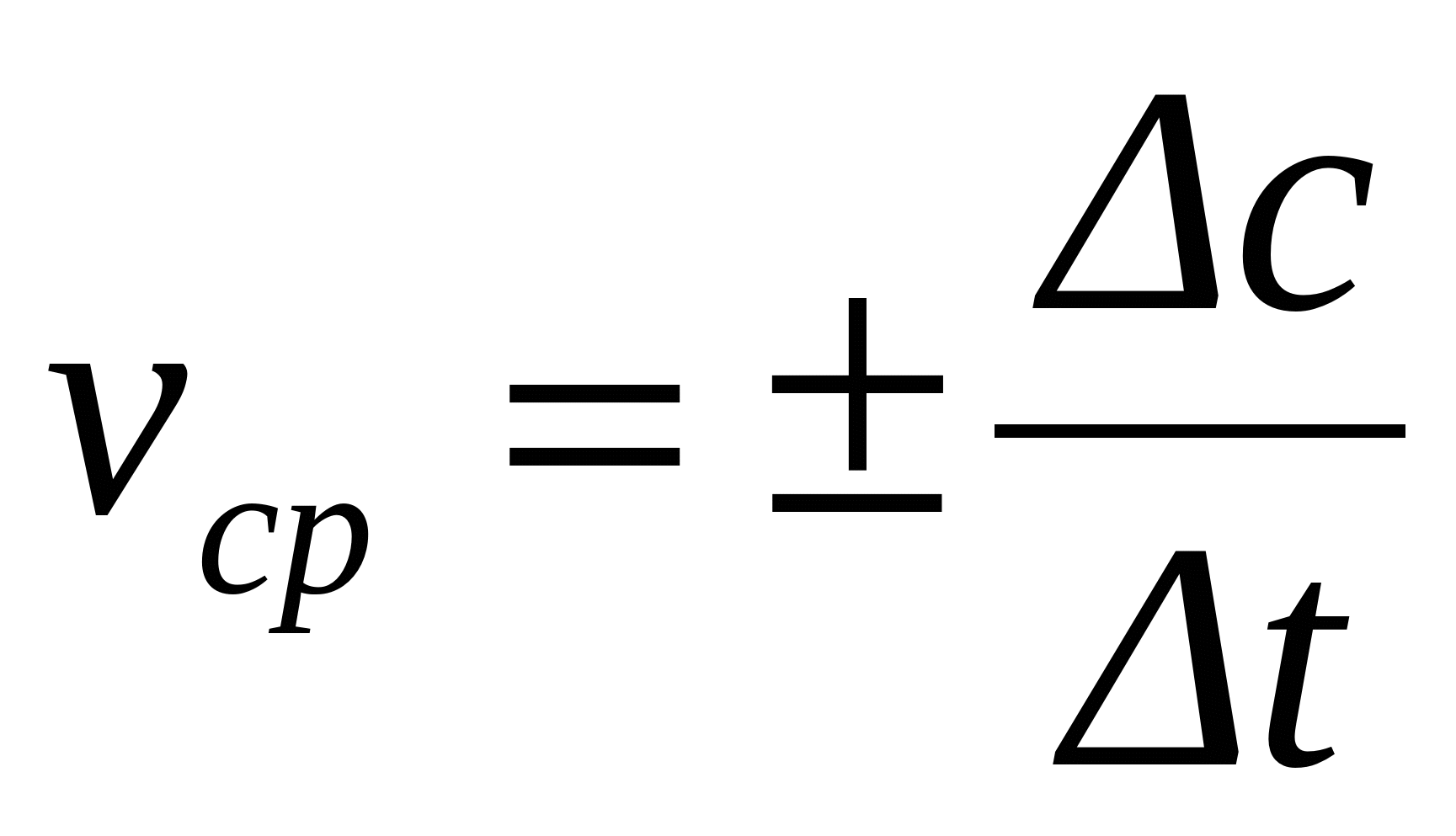
Химичната кинетика има за чел да изучи скоростта на химичните процеси и факторите, които влияят върху нея. За определени условия не всички химични реакции протичат с еднаква скорост.
Скоростта на дадена химична реакция се измерва с промяната на концентрацията на реагиращите вещества или на получените крайни продукти за единица време. Обикновено се оперира с концентрацията на нереагиращите вещества. Тя се изразява в грам-молове на литър, а времето - в секунди, минути, дори и месеци, в зависимост от скоростта на процеса. Тъй като с течение на времето концентрацията на изходните вещества намалява, естествено ще намалява и скоростта на реакцията. И във връзка с това различаваме средна скорост на реакцията за сравнително голям промеждутък от време и истинска скорост в даден момент или:
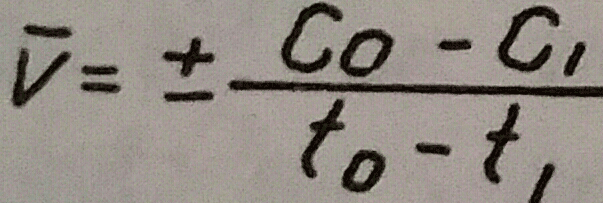
С V (с горна чертичка) се обозначава средната скорост, Co-C1 - промяната на концентрацията за промеждутъка време, t0-t1 и v=+-(dc)/(dt), където V е истинската скорост, dc - безкрайно малко изменение на концентрацията, dt - безкрайно малък интервал от време. Знакът +- се поставя според това кои вещества са използвани - изходните, които намаляват, или тези на крайните продукти, които с времето се увеличават. Скоростите имат винаги положителни стойности.
Върху скоростта на химичните реакции оказват влияние следните фактори.
Природа на реагиращите вещества
Тя е изразена чрез химичната връзка и междумолекулното взаимодействие. Вещества с ковалентна връзка, общо взето, реагират с малка скорост, тъй като тази връзка е здрава. Йонно построените вещества в разтвор реагират с голяма скорост. Химичните процеси, най-общо казано, са разграждане ан едни частички (изходните вещества) и изграждането на други градивни частички (на крайните продукти). Ако структурите на изходните градивни частички е близка до структурата на градивните частички на крайните продукти, процесът протича с относително голяма скорост. В противен случай - със съответна по-малка скорост.
Агрегатно състояние
Общо взето веществата в газово агрегатно състояние реагират с най-голяма скорост, след това тези в течно агрегатно състояние и най-бавно в твърдото агрегатно състояние. Това е обяснимо, тъй като реакциите между веществата в газовото агрегатно състояние са обемни реакции, а останалите особено в твърдото агрегатно състояние са повърхностни процеси. При оситняване на твърдите вещества и диспергиране на течните поради увеличение на контакта между реагиращите вещества "скоростта на реакцията", при еднакви други условия съответно се увеличава.
Природа на разтворителя
Той може да бъде газ или течност и влияе със своята поляризираща или каталитична способност и прочие. При водата, според това дали има кисела или основна реакция, тя също оказва влияние при еднакви други условия.
Температура
Съществува правилото, че повишението на температурата с 10 градуса по Целзий увеличав скоростта на химичната реакция от 2 до 4 пъти. Това е температурният коефициент на скоростта на химичните процеси, но отнасящ се за процеси между газове и донякъде между течни системи. За реакциите между твърди вещества правилото не важи, понеже те са гранично повърхностни, за разлика от другите, които са обемни. За да протече процесът с два пъти по-голяма скорост при твърдите вещества, трябва да се повиши температурата с няколко стотин градуса дори и повече. Влиянието на температурата се обяснява с това, че тя променя преди всичко скоростта на движението на молекулите, вследствие на което се изменя броят на ударите между тях за единица време, както и силата на удара. Не е лишно да се отчете, че съществуват няколко реакции между газове, при които скоростта с повишение на температурата намалява и обратно, с понижение на температурата скоростта се увеличава. Един такъв процес е 2NO+O2=2NO2. Обяснението е, че механизмът на процеса е много сложен.
според кинетичната теория на газовете, както се спомена по-горе, една молекула за една секунда се удря в съседните й молекули 109 пъти, като времето на престояване в момента на удара е от порядъка на 10-13 секунди. Очевидно би трябвало всички реакции между газове да протичат експлозивно, а това не е така. Освен това температурният коефициент на скоростта не е един и същ. Тези два факта и други доведоха до заключението:
- а) Не всеки удар между молекулите на двата реагиращи помежду си газа означава химична реакция.
- б) От съществено значение са само ударите между особен вид молекули, които в момента на удара да са в подходящо пространствено разположение. Те се обозначиха като активни молекули, които са ненормално енергитично богати. Броят на ударите между тях, наречени ефективни (благоприятни) при подходящо взаимно разположение една спрямо друга в момента на удара (така нареченият стеричен ефект) определя скоростта на химичния процес.
Концентрация
С увеличение на концентрацията на реагиращите вещества очевидно скоростта на реакциите ще се увеличава поради увеличението на броян а ударите между молекулите за единица време, дори те да бъдат само активните молекули. Въз основа на обширен експериментален материал норвежките учени Гулдберг и Вааге (1867) формулирали закона за действието на масите - скоростта на химичната реакция в даден момент е правопропорционална на произведението от грам-молните концентрации на реагиращите вещества в този момент. Или ако съществува реакцията A+B=C и c[A] и [B] се означават концентрациите на веществата за литър (A и B), получава се изразът v=kpA][B], в който V е скоростта на реакцията, а k - така наречената скоростна константа. Тя зависи от природата на веществата и температурата, като се увеличава с нейното повишение. При процеса mA+nB=C тя е съответно v=k[A]m[B]n - коефициентите m и n в химичното уравнение стават степени в израза за скоростта на реакцията.
Скоростната константа k представлява скорост при предпоставката, че [A] и [B] са равни на единица, тоест взети в грам-молни количества за литър.
При хетерогенните химични процеси, тоест където съществува фазова граница, количеството на кондензираната фаза не участва в израза за зависимостта на скоростта на химичните реакци иот концентрацията. Например при процеса C+O2=CO2 изразът не е v=k[c][CO2], а v=k[O2], тоест скоростта на процеса зависи само от концентрацията на кислорода, от неговото налягане.
Присъствието на чужди вещества включително природата на стените на съда. Ролята на чуждите вещества в реагиращата система се свежда до ролята на катализатори, които могат да променят положително или отрицателно скоростта на химичния процес до 1000 и повече пъти. От значение е и природата на стените на съда, в който се намира реагиращата система. Например реакцията между H2 и O2 протича мигновено при обикновена температура в платинов съд, а към 4500C - в стъклен съд. Също така процесът между H2 и F2 протича с експлозия при температурата на течния въздух (към -1900C), когато сместа се намира в стъклен съд, при обикновена температура - в сребърен съд, и при съответно висока температура - в съд, направен от магнезий и прочие. И тук влиянието на стените се свежда до каталитично влияние.
Току-що изложеното подчертава, че чисто "обемни" реакции между газовете не са познати, тоест реакцията между H2 и F2 да започва в обема на системата и да се разпространява към стениет на съда. Всичко говори, че процесът започва на граничната повърхност H2-F2I стъкло и оттам се разпространява в целия обем на газовата система. Иначе няма как да се обясни влиянието на природата на стените на съда върху започването на химичната реакция. При хетерогенните химични процеси от значение е и скоростта на дифузията на едното вещество към другото, както и скоростта на дифузията на получения продукт от повърхността - на твърдата фаза в посока на обема на системата. Чрез разбъркване тези два дифузионни процеса се ускоряват и оттук и скоростта на химичната реакция при еднакви други условия.