
Това са молекулно или йонно дисперсните системи. Дисперсната среда тук се нарича разтворител, а дисперсната фаза - разтворено вещество. Принципна разлика между тези две съставки на разтвора не съществува особено при течност-течност. Приема се, с известни уговорки и изключения за разтворител веществото, което е в излишък. Най-често употребимият разтворител в живтоа е водата. Ако при някои разтвори не е споменат разтворителят - разбира се за водата.
Съществуват два гранични случая на смесваемост / разтворител - разтворено вещество/ - ограничена и неограничена. При ограничената смесваемост при дадени условия се получава ненаситен, наситен и преситен разтвор. Ненаситен е, когато разтворът може още да разтваря. Той винаги е хомогенен. Наситен е, когато разтворът повече не може да разтваря. При разтворено вещество течност или твърдо той е хетерогенна система. Например KCl /твърдо/ - наситен разтвор - пари или бензол /течност/ - наситен разтвор - пари на системата и прочие. При наситения разтвор се осъществява динамично равновесие между трите фаза на системата. Преситен е разтворът, когато съдържа по-големи количества от разтворимото вещество, отколкото наситеният разтвор за дадените условия. Преситените разтвори са хомогенни системи, нестабилни и не се реализират от всички вещества. Те са присъщи най-вече на кристалните соли Na2SO4.10H2O, Na2S2O3.5H2O и прочие. Че са нестабилни системи говорят немалко факти. Ако се прибави кристал от разтвореното вещество или се търкат стените на стъкления съд със стъклена пръчка, или пък енергично се разтърси преситеният разтвор, протича процес на кристализация, като се получава съответният наситен разтвор при отделяне на топлина.
Количеството разтворено вещество, отнесено за определен обем или маса от разтвора, или разтворителя се нарича концентрация. Според нейната стойност различават се разредени и концентрирани разтвори. Трябва да се прави разлика между наситен разтвор и разреден разтвор. Наситените разтвори на BaSO4, CaCO3, въобще малко разтворимите във вода вещества, са извънредно разредени.
Има няколко начина за изразяване на концентрацията. Процентната масова концентрация се дава с грамовете разтворено вещество в 100 грама разтвор. 10%-ен разтвор от KCl означава, че в 90 грама вода са разтворени 10 грама KCl. Моларната концентрация /моларност или молност/ представлява броят грам-молове разтворено вещество в 1 литър разтвор. Разтворите се наричат моларни и се означават с М или m. Молялна концентрация (молялност) е също както в предния случай, но сметнато за 1000 грама разтворител. Нормалната концентрация /нормалност/ се изразява с броя на грам-еквиваленти разтворено вещество в 1 литър разтвор. Разтворите се наричат нормални и се означават с N или n. Грам-еквивалентът на киселините, основите и солите се наричат както следва:
- а) При киселините молекулната маса е разделена с основността киселина.
- б) При основите молекулната маса е разделена с валентността на метала.
- в) При солите молекулната маса е разделена с произведението от броя атоми на метала по тяхната валентност.
Тъй като обемите на разтворите зависят от температурата, прието е обикновено да се дават за 200C. За някои видове разтвори концентрацията се дава в обемни проценти.
Ако съдържанието на разтвореното вещество се отнася за наситен разтвор за определена температура и при това за 100 грама разтвор или разтворител или за 100 cm3 разтвор или разтворител, това съдържание се обозначава като разтворимост на веществото. Разтворимостта не е способност. Последната се обозначава с разтворяемост.
Най-често срещаните в практиката разтвори при разтворител вода са следните:
- Разтвори на твърди вещества в течности.
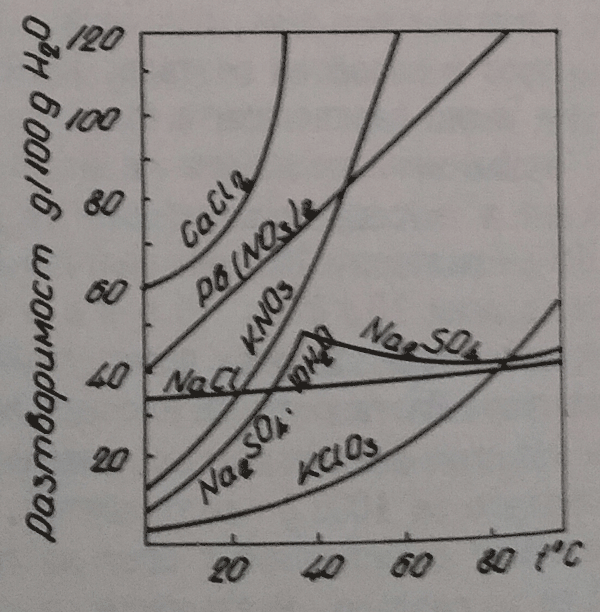 Според разтворимостта съществуват много разтворими /KCl, NaNO3, KI и прочие/, средно разтворими /PbCl2, CaSO4 и други/ и малко разтворими, понякога обозначавани като неразтворими /AgCl, BaSO4, CaCO3 и прочие/ вещества. С повишаване на температурата много кристални вещества увеличават разтворимостта /KClO3, KNO3NH4Cl и много други/, други я намаляват /Na2SO3 над 40 градуса по Целзий, Y2(SO4)3, La2(SO4)3 и прочие/, а трети практически не я изменят /NaCl, KF над 40 градуса по Целзий и други/. Зависимостта разтворимост - температурата се нарича крива на разтворимост /фигура 24/. Кривата на разтворимост на Na2SO4.10H2O има счупване при 32,38 градуса по Целзий /температура на преминаване/. В такива случаи по принцип се явява нова твърда фаза /в случая Na2SO4 - безводен/, на който разтворимостта с повишаване на температурата на малява. Разтворимостта при неизменни условия зависи от налягането, но в много малка степен. процесът на разтваряне винаги е съпроводен с топлинен ефект. Как се променя разтворимостта на твърдите вещества при повишение на температурата във връзка с топлинния ефект на разтворителния процес е дадено при "Принцип на Льо Шателие-Браун". Разтворителният процес има своя скорост. Дава се с количеството вещесво, което преминава от единица повърхнот за единица време от повърхността на твърдото вещество в разтвора за дадените условия. В началото скоростта на разтварянето е най-голяма. Тя зависи от температурата, разбъркването, но не и от степента на стриването на кристалната система. При по-голяма оситненост разтварянето по-бързо завършва поради по-голямата допирна повърхност между разтворителя и разтварящото се вещество.
Според разтворимостта съществуват много разтворими /KCl, NaNO3, KI и прочие/, средно разтворими /PbCl2, CaSO4 и други/ и малко разтворими, понякога обозначавани като неразтворими /AgCl, BaSO4, CaCO3 и прочие/ вещества. С повишаване на температурата много кристални вещества увеличават разтворимостта /KClO3, KNO3NH4Cl и много други/, други я намаляват /Na2SO3 над 40 градуса по Целзий, Y2(SO4)3, La2(SO4)3 и прочие/, а трети практически не я изменят /NaCl, KF над 40 градуса по Целзий и други/. Зависимостта разтворимост - температурата се нарича крива на разтворимост /фигура 24/. Кривата на разтворимост на Na2SO4.10H2O има счупване при 32,38 градуса по Целзий /температура на преминаване/. В такива случаи по принцип се явява нова твърда фаза /в случая Na2SO4 - безводен/, на който разтворимостта с повишаване на температурата на малява. Разтворимостта при неизменни условия зависи от налягането, но в много малка степен. процесът на разтваряне винаги е съпроводен с топлинен ефект. Как се променя разтворимостта на твърдите вещества при повишение на температурата във връзка с топлинния ефект на разтворителния процес е дадено при "Принцип на Льо Шателие-Браун". Разтворителният процес има своя скорост. Дава се с количеството вещесво, което преминава от единица повърхнот за единица време от повърхността на твърдото вещество в разтвора за дадените условия. В началото скоростта на разтварянето е най-голяма. Тя зависи от температурата, разбъркването, но не и от степента на стриването на кристалната система. При по-голяма оситненост разтварянето по-бързо завършва поради по-голямата допирна повърхност между разтворителя и разтварящото се вещество.
Разтварянето на едно кристално вещество във вода е доста сложен процес, изграден от няколко елементарни процеса, които имат свои било положителни, било отрицателни топлинни ефекта. Тези процеси са разграждане на кристалната решетка, междумолекулното взаимодействие между градивните частички на кристала и тези на разтворителя, дифузионният процес и прочие. Чрез тях се обяснява различието между кривите на разтворимост за различните кристални вещества. - Разтвори на течности в течности. Тук съществуват случаи на неограничена смесваемост /спирт-вода, ацетон-вода и прочие/ и на ограничена смесваемост /етер-вода, фенол-вода и прочие/.
Обръща внимание ограничената смесваемост на фенола във водата и на водата във фенола. За обикновена температура двете течности са разслоени. При повишение на температурата взаимната смесваемост се увеличава, ограничената смесваемост преминава в неограничена, разслоеност - намалява и над 68 градуса по Целзий смесваемостта става неограничена. Под 68 градуса по Целзий системата е хетерогенна - двуфазна, а над 68 градуса по Целзий е хомогенна. Тази температура, при която хетерогенната система течност-течност /ограничена смесваемост/ преминава в хомогенна /неограничена смесваемост/ се нарича критична температура на разтворимост. При системата никотин-вода съществуват две критични температури на смесваемост - горна /210 градуса Целзий/ и долна /60 градуса Целзий/.
Ако се изследва общото налягане на парите на разтвора при дадена температура в зависимост от състава на разтвора при случаите на неограничена смесваемост очертават се 4 типа зависимости - с екстремуми/максимум, минимум, максимум и минимум/ и без екстремуми. Във връзка с посоченото, ако искаме да разделим двете течности чрез дестилация върху основата на разликата им в температурата на кипене, оказва се, че това е възможно само при зависимостта без екстремуми. Останалите са неразделими. Последните се наричат азеотропни /спирт-вода, хлороводород-вода и прочие/, а разделимите - аназеотропни /азот-кислород, амоняк-вода и прочие/. Тези зависимостти са изучени подробно най-вече от руския химик Д. П. Коновалов и намерените закономерностите са известни като законите на Коновалов. Те са важни за решаването на много въпроси в промишлеността, свързани с кипенето, дестилацията, разделянето на течностите помежду им и прочие. - Разтворими на газове в течности. Принципно положение е, че всички газове са разтворими повече или по-малко във всички течности. Разтворимостта зависи от природата на газа и течността, от температурата и налягането. При повишаване на температурата разтворимостта на газовете по принцип намалява, тъй като топлинният ефект на разтварянето е положителен. По правило при еднакви други условия газовете са повече разтворими в разтворители с по-малка полярност на молекулата.
Зависимостта между налягането и разтвореното количество газ се изразява със закона на Хенри - масата на разтвореното количество газ е пропорционално на налягането при определен обем течност и неизменна температура. Дават се и други формулировки на закона. Той е валиден при предпоставките да не се изменя молекулното състояние на газа, разтворът да бъде относително разреден, да не протича силно изразен химичен или физичен процес между градивните частички на газа и разтворителя и прочие. Законът не е валиден при системата SO2-H2O при обикновена температура, тъй като протича процесът SO2 + H2O⇔ H2SO3. Но при високи температури той е валиден поради това, че H2SO3 се разлага практически напълно на SO2 и H2O. Не е валиден и при системата HCl-H2O, тъй като се намесва електролитната дисоциация на молекулите на хлороводорода. - Разтвори на газове в метални системи. Разтварянето се нарича оклюзия. Най-добре е изучена оклюзията на водорода в металите и по-специално в паладия. Намира приложение при "омекотяването" на вакуума в рентгеновите тръби, при получаването на съвършено чист водород, при хидрирането на мазнините и прочие.