След като са били установени законите при разредените разтвори, оказало се, че известен немалък брой вещества /киселини, основи и соли/ във водни разтвори правят по-малки или по-големи отклонения от тези закономерности, отклонения, при които еднакви други условия стоят в тясна връзка с изразеността на електропроводимостта на разтворите им. Например водния разтвор на NaCl вместо да показват молекулно понижение на температурата на замръзване 1,86, показвал 3,5, а при BaCl2, CaCl2, то било около три пъти по-голямо и т.н.
Същото се отнасяло и за осмотичното налягане и прочие. Тези вещества били електролитите. За За да се направят законите за разредените разтвори приложини и към тях, налагало се пред съответните матерматични изрази да се поставят известни корекционни фактори. И през 1887 г. Сванте Арениус, като обърнал внимание за тясната връзка между електропроводността на тези обърнал внимание за тясната връзка между електропроводността на тези разтвори и отклоненията, подчерта;. че последните във вода самоволно се дисоциират на електрично заредени частички, които определят електропроводността и са причина за отклоненията, тоест разтворите да бъдат по-концентрирани, отколкото ако са в молекулно състояние, в която, хроникиращо дадено, залегнали следните положения;
- Молекулите се дисоциират еквивалентно на положително и отрицателно заредени йони съответно катиони и аниони така, че разтворът като цяло е електронеутрален.
- При "пропускане" на ток катионите се придвижват към катода, а анионите към анода, където се отелектризират и се получават съответните прости вещества, тоест това е електролизата.
- Процесът е моментален и равновесен между дисоцииралите се молекули и получените йони.
- Поради електричния заряд йоните притежават свойства съвсем различни от съответните атоми - хлорният атом е отровен,хлорният йон не е отровен и прочие.
- Разликата между електролити и неелектролити не е рязка.
- Електролитната дисоциация се изразява с уравнения, аналогични на химичните уравнения. Катионите се означават с (.), а анионите с (') или пък както е понастоящем е съответно (+) и (-) -KCl⇔K.+Cl' или KCl⇔K++Cl-.
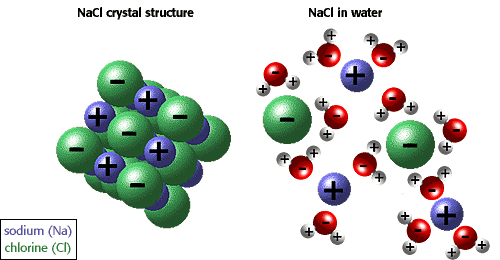
Като се има предвид гореизложеното в "Строеж на твърдите вещества", че съществуват йонно построени кристали и прочие, става ясно какъв е механизмът на електролитната дисоциация. При поставяне на кристала от KCl във вода, върху повърхността му, към съответните повърхностно лежащи йони, електростатично се ориентират диполните водни молекули, които, като формират по-здравата диполно-йонна връзка, отколкото между йонното взаимодействие в кристала, "измъкват" готовите йони и те съответно хидратирани се придвижват дифузионно в останалата част на разтвора. Така че механизмът на електролитната дисоциация е по-друг, отколкото този, който бе дал Арениус при разтварянето на KCl във вода, че наличните негови молекули равновесно се дисоциират на йони. Аналогично протича електролитната дисоциация и при популярно изградените съединения. Притъкмилите се към двата края на полярната молекула на HCl, диполните водни молекули, като трептят, разкъсват полярната връзка, при което сеп олучават хидрирани йони.
Различните йони са разлино хидратирани. Водородният йон е хидратиран с една молекула вода и има състава H3O+, наричан оксониев или хидроксониев йон. Броят молекули, хидриращи даден йон, има статистичен смисъл, колебае се около една средна стойност. Междувпрочем зависи и от йонния радиус. Броят молекули вода, свързани с йона, дават отпчеатък върху неговата подвижност. При по-голям брой - по-малка подвижност и обратно, независимо от йонния радиус. Най-подвижни са H+ и OH- йони.
В металните проводници електропроводността се свежда до придвижването на поток от електрони от отрицателния към положителния полюс на източника за прав ток. При електролитните разтвори електропроводността има по-друга картина - ориентирането и придвижването на готовите йони /катиони и аниони/ към съответните електроди представлява "протичането" на ток през електролитния разтвор.