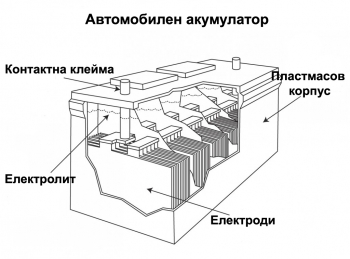
Ако се постави Zn-ова пръчка в разтвор на CuSO4 в съответствие с местата на цинка и медта в електроафинитетния ред ще протече процесът Zn+CuSO4=ZnSO4+Cu или йонно изразен Zn+Cu2+=Zn2+Cu. Електронният обмен между цинковите атоми и Cu2+ в случая става на повърхността на метала. Върху Zn се отлага елементарна Cu. Ако се осъществи електронният обмен не непосредствено, а чрез проводник, по него ще протече поток от електрони, тоест електричен ток. На фигура 26 е дадена най-простата схема на галваничния елемент, тоест уредба, която прави възможно преминаването на електрони по проводник. Съдът А и тръбичката B са напълнени с разтвор на ZnSO4, а съдът Б - с разтвор на CuSO4. В първия съд е поставена цинкова, а във втория медна пластинка. Ако се съединят двете пластинки с проводник, по него протича електричен ток в посока Zn-Cu, тъй като Zn е по-богат на свободни електрони отколкото Cu. Така че Zn се явява отрицателен полюс на елемента, а Cu положителен полюс. Придвижването на електрони от Zn към Cu прави първия да придобива положителен заряд, а вторият отрицателен, но това не се осъществява, тъй като съответно количество Zn2+ преминават от метала в разтвор (на ZnSO4), а при Cu прииждащите електрони, преминават от метала към Cu2+ (от CuSO4) и те, станали електронеутрални, отлагат елементарна мед върху медната пластинка. Едновременно съответна част Zn2+ преминават по тръбата B от съда А в съда Б. Ако претеглим Zn-та пластина и Cu-та пластина се установява, че загубата в маса при Zn е еквивалентна на увеличената маса при Cu, тясно свързани с преминалото количество свободни електрони (електричество) по проводника В. Впрочем галваничният елемент предтавлява една изразена окислително-редукционна система.
 Акумулаторите, както и галваничните елементи, са химични източни на ток (електрична енергия). Но докато вторите се обозначават като първични елементи, тъй като след изтощаването им е невъзможно чрез съответно количество електрическа енергия, първоначалното им състояние да се възстанови, тоест да се заредят отново с електричество, първите се наричат вторични елементи.
Акумулаторите, както и галваничните елементи, са химични източни на ток (електрична енергия). Но докато вторите се обозначават като първични елементи, тъй като след изтощаването им е невъзможно чрез съответно количество електрическа енергия, първоначалното им състояние да се възстанови, тоест да се заредят отново с електричество, първите се наричат вторични елементи.
Най-употребяваният е оловният акумулатор, изграден от две перфорирани решетъчни оловни плочи, в които е вграден по съответна технология PbO и поставени в 25-30%-ен разтвор на сярна киселина. Така че първоначално върху двете плочи се намира PbSO4; PbO+H2SO4=PbSO4+H2O.
При зареждането на акумулатора с ток на катода се формира от PbSO4 гъбесто олово, а на анода кафявия PbO2. Без да се отива подробности сумарно зареждането на акумулатора може да се изрази с уравнението:
(разреждане) Pb+PbO2+2H2SO4⇔2PbSO4+2H2O (зареждане).
Очевидно при зареждането концентрацията на сярната киселина се увеличава, а при разреждането - намалява. Електродвижещата сила на оловния акумулатор, зареден, възлиза на около 2,04 волта. При разреждането му тя спада на 1,85 волта. Наред с оловния акумулатор в практиката се срещат още никелово-кадмиевият, никелово-железният, сребърно-цинковият и други акумулатори.
През последните десетки години се развиха и използват така наречените горивни (топливни) елементи, принципната схема на които може да се даде както следва: гориво | електролит | O2 | неактивен електрод. Теоритично електродвижещата сила на тези елементи се определя от топлината на изгаряне на горивото. За такова се използва H2, CO, C, спирт и други органични склонни към електрохимично окисление вещества. Най-перспективно гориво се явява водородът. Разработени са различни конструкции за този тип химичен източник на ток. Въпреки че електродвижещата сила при тях не е висока (0,7-0,9 волта), коефициентът на полезното действие е близък до 100%, тоест налице е практически пълно превръщане на топлинната енергия в електрична.